题目内容
10.A、B、C、D四种短周期元素,A 与C同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,D元素原子的最外层电子数是其次外层电子数的3倍.(1)A的原子结构示意图为
 .
.(2)以A的单质和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池总反应的化学方程式是Al+3NiO(OH)+H2O+NaOH═NaAlO2+3Ni(OH)2.
(3)化合物甲由元素A、B组成,具有良好电绝缘性化合物甲能与水缓慢反应生成含B的化合物乙,乙分子中含有10个电子.写出该反应的化学方程式:AlN+3H2O=Al(OH)3↓+NH3↑.
(4)C和D两种元素相比较,非金属性较强的是(填元素名称)氧,可以验证该结论的是(填写编号)bc;
a.比较这两种元素的常见单质的沸点 b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性 d.比较这两种元素的气态氢化物的沸点.
分析 A、B、C、D五种短周期元素,A的单质既可与盐酸反应,又可与NaOH溶液反应,则A为Al;A与C同周期,C元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,则最外层电子数为6,故C为S元素;B的单质在放电条件下能与氧气反应,则B为N元素;D元素原子的最外层电子数是其次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故D为O元素,据此解答.
解答 解:A、B、C、D五种短周期元素,A的单质既可与盐酸反应,又可与NaOH溶液反应,则A为Al;A与C同周期,C元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,则最外层电子数为6,故C为S元素;B的单质在放电条件下能与氧气反应,则B为N元素;D元素原子的最外层电子数是其次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故D为O元素.
(1)A为Al,原子核外有3个电子层,各层电子数为2、8、3,其原子结构示意图为 ,
,
故答案为: ;
;
(2)以Al的单质和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,Al失去电子,碱性条件下生成偏铝酸钠,该电池总反应的化学方程式是:Al+3NiO(OH)+H2O+NaOH═NaAlO2+3Ni(OH)2,
故答案为:Al+3NiO(OH)+H2O+NaOH═NaAlO2+3Ni(OH)2;
(3)化合物甲由元素Al、N组成,具有良好电绝缘性,甲为AlN,能与水缓慢反应生成含N元素的化合物乙,乙分子中含有10个电子,则乙为NH3,反应为水解反应,同时生成氢氧化铝,该反应的化学方程式为:AlN+3H2O=Al(OH)3↓+NH3↑,
故答案为:AlN+3H2O=Al(OH)3↓+NH3↑;
(4)O、S同主族,自上而下非金属性减弱,故氧元素非金属性较强,
a.单质的沸点属于物理性质,不能比较非金属性强弱,故a错误;
b.单质与氢气反应越容易,元素非金属性越强,故b正确;
c.非金属性越强,对应元素氢化物越稳定,故c正确;
d.氢化物沸点高低由分子间注意力决定,不能比较元素非金属性强弱,故d错误,
故答案为:氧;bc.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重考查学生对知识的迁移应用与分析解决问题能力,难度中等.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案①加热试管时,先均匀加热,后局部加热
②做H2还原CuO实验时,先通H2,后加热CuO,反应完毕后,先撤酒精灯待试管冷却,后停止通H2
③制取气体时,先检查装置气密性,后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度,后点燃
⑤制取蒸馏水时,先通冷却水,后加热烧瓶
⑥进行分液操作时,先从上口倒出上层液体,后从通过下端活塞放出下层液体.
| A. | ①②③④ | B. | ①②③④⑤ | C. | ①②③④⑥ | D. | 全部 |
| A. | 明矾既可用于净水,又可杀菌消毒 | |
| B. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| C. | 双氧水可用于杀菌、消毒、漂白 | |
| D. | 家中发生天然气泄漏,不能在室内用电话报警 |
| A. | 在复盐NH4Fe(SO4)2溶液中加入过量的Ba(OH)2溶液:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O | |
| B. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 | |
| C. | 在燃煤时加入适量石灰石粉末,可减少SO2的排放:CaCO3+SO2═CaSO3+CO2 | |
| D. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2H++2I-+H2O2═I2+2H2O |
 向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用如图简单表示(“-”表示铁各种价态的变化,用“-•-”表示碘各种形态的变化).下列结论错误的是( )
向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用如图简单表示(“-”表示铁各种价态的变化,用“-•-”表示碘各种形态的变化).下列结论错误的是( )| A. | Cl2、I2、IO3-、Fe3+的氧化性依次减小 | |
| B. | 当$\frac{n(C{l}_{2})}{n(Fe{I}_{2})}$=1.2时,反应的离子方程式为2Fe2++10I-+6Cl2═5I2+2Fe3++12Cl- | |
| C. | 当$\frac{n(C{l}_{2})}{n(Fe{I}_{2})}$=6.5时,溶液中$\frac{n(C{l}^{-})}{n(I{O}_{3}^{-})}$=6.5 | |
| D. | 若溶液的体积不变,则溶液的pH减小 |
| 步骤 | 操作 | 现象 |
| (1) | 用紫色石蕊试液检验 | 溶液变红 |
| (2) | 向溶液中滴加BaCl2和稀HCl | 有白色沉淀生成 |
| (3) | 将(2)中所得混合物过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀生成 |
| A. | 肯定含有的离子是②③⑥ | B. | 肯定没有的离子是④⑤ | ||
| C. | 可能含有的离子是①③ | D. | 可能含有的离子是① |
| A. | 阴阳两极都是石墨 | B. | 铜作阳极,铁作阴极 | ||
| C. | 铁作阳极,铜作阴极 | D. | 铜作阳极,铂作阴极 |

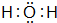 D 的原子结构示意图
D 的原子结构示意图 .
.