题目内容
14.某电解池内盛有CuSO4溶液,插入两根电极,接通直流电源后,欲达到如下要求:①阳极质量不变 ②阴极质量增加 ③电解液pH减小,则应选用的电极是( )| A. | 阴阳两极都是石墨 | B. | 铜作阳极,铁作阴极 | ||
| C. | 铁作阳极,铜作阴极 | D. | 铜作阳极,铂作阴极 |
分析 某电解池内盛有CuSO4溶液,插入两根电极,接通直流电源后,欲达到如下要求:①阳极质量不变 ②阴极质量增加 ③电解液pH减小,说明阳极上电极材料不参加反应且阳极上氢氧根离子放电,阴极上析出金属单质,据此分析解答.
解答 解:某电解池内盛有CuSO4溶液,插入两根电极,接通直流电源后,欲达到如下要求:①阳极质量不变 ②阴极质量增加 ③电解液pH减小,说明阳极上电极材料不参加反应且阳极上氢氧根离子放电,阴极上析出金属单质,
A.如果阴阳两极都是石墨,则阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成Cu,导致溶液中氢离子浓度大于氢氧根离子浓度,溶液酸性增强,符合条件,故A正确;
B.如果Cu作阳极、Fe作阴极,相当于电镀,阳极质量减小、电解质溶液pH不变,故B错误;
C.如果Fe作阳极、Cu作阴极,则阳极质量减小,故C错误;
D.如果Cu作阳极、Pt作阴极,相当于电镀,阳极质量减小、电解质溶液pH不变,故D错误;
故选A.
点评 本题考查电解原理,为高频考点,如果阳极是活性电极时,阳极上电极材料失电子而不是电解质溶液中阴离子失电子,为易错题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.常温下,pH>7的某溶液中只含有Na+、CH3COO-、H+、OH-四种离子,下列描述正确的是( )
| A. | 该溶液只能由等物质的量浓度、等体积的氢氧化钠溶液和醋酸溶液混合而成 | |
| B. | 该溶液一定由pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合而成 | |
| C. | 该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 加入一定冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
2.直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表所示:
①由上表判断,NaHSO3溶液显酸性,用化学平衡原理解释HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
②当吸收液呈中性时,下列溶液中离子浓度关系正确的是(选填字母)ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
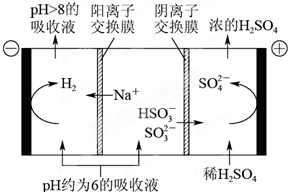
①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理氢离子在阴极得电子生成氢气,溶液中OH-浓度增大,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表所示:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,下列溶液中离子浓度关系正确的是(选填字母)ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:

①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理氢离子在阴极得电子生成氢气,溶液中OH-浓度增大,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
9.下列说法中不正确的是( )
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | Na2CO3溶液比NaHCO3溶液碱性强 | |
| D. | 碳酸钠与盐酸反应放出二氧化碳的剧烈程度强于碳酸氢钠 |
19.已知:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多,A、B、C、D的电子数如表(A、B、C、D有两组可能),且D中的电子数等于质子数,D1可作医用消毒液. 其中B1的沸点比B2高.
试回答下列问题:
(1)如表两组八种微粒的组成元素中,非金属性最强的元素在元素周期表的位置是第二周期第VI族;
(2)液态的B2与Na反应类似于B1与Na反应,写出液态的B2与Na反应的化学方程式:2Na+2NH3(l)=2NaNH2+H2↑.
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备化学反应方程式2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,其中D1的作用是还原剂.
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与Iˉ发生反应的氧化性杂质)的纯度,过程如图(已知:I2+2S2O32ˉ═S4O62ˉ+2Iˉ):
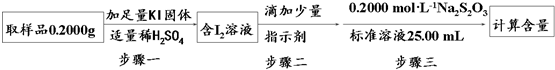
步骤一的离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O;步骤二的指示剂是淀粉;步骤三中出现溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为90.3%.(保留小数点后一位)
| ① | A1 | B1 | C1 | D1 |
| 电子数 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 电子数 | 10 | 10 | 10 | 18 |
(1)如表两组八种微粒的组成元素中,非金属性最强的元素在元素周期表的位置是第二周期第VI族;
(2)液态的B2与Na反应类似于B1与Na反应,写出液态的B2与Na反应的化学方程式:2Na+2NH3(l)=2NaNH2+H2↑.
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备化学反应方程式2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,其中D1的作用是还原剂.
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与Iˉ发生反应的氧化性杂质)的纯度,过程如图(已知:I2+2S2O32ˉ═S4O62ˉ+2Iˉ):

步骤一的离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O;步骤二的指示剂是淀粉;步骤三中出现溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为90.3%.(保留小数点后一位)
6.设NA为阿伏加德罗常数的值,下列说法中不正确的是( )
| A. | 常温常压下,17 g NH3中含有的电子总数为10NA | |
| B. | 常温常压下,14g的C2H4和C3H6混合气体含有的氢原子数为2NA | |
| C. | 常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA | |
| D. | 标准状况下,22.4 L 的N2O和CO2混合气体中含有的电子总数为22NA |
3.下列有关化学用语正确的是( )
| A. | 聚丙烯的结构简式: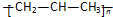 | B. | 二氧化碳的电子式: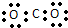 | ||
| C. | 中子数为18的硫原子:${\;}_{16}^{34}$S | D. | 乙醇的分子式:CH3CH2OH |
4.化学与生产、生活密切相关.下列叙述错误的是( )
| A. | 中国古代利用明矾的溶液的酸性清除铜镜表面的铜锈 | |
| B. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| D. | 喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 |
 .
.