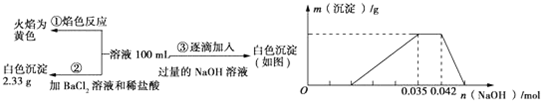
题目内容
5.化学知识在生产和生活中有着重要的应用.下列说法错误的是 (?)| A. | 明矾既可用于净水,又可杀菌消毒 | |
| B. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| C. | 双氧水可用于杀菌、消毒、漂白 | |
| D. | 家中发生天然气泄漏,不能在室内用电话报警 |
分析 A、明矾不具有杀菌作用,只能净水;
B、漂白精有效成分是次氯酸钠是强氧化剂,洁厕精主要是盐酸可以被氧化为有毒的氯气;
C、双氧水有强氧化性;
D、天然气的成分为甲烷,遇明火发生爆炸;
解答 解:A、明矾中的铝离子水解得到的氢氧化铝能净水,但是不具有杀菌作用,故A错误;
B、漂白精的主要成分为次氯酸钠,洁厕精的主要成分是浓盐酸,两者相遇会产生有毒气体氯气,故B正确;
C、双氧水有强氧化性,可用于杀菌、消毒、漂白,故C正确;
D、然气的主要成分是甲烷,遇明火会爆炸,所以家中发生天然气泄露时,不能使用室内电话报警,故D正确;
故选A.
点评 本题考查化学实验安全和消毒剂,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.

练习册系列答案
相关题目
15.下列反应过程需要吸收热量的是( )
| A. | 燃烧 | B. | 浓硫酸溶于水 | C. | 酸碱中和 | D. | 水的电离 |
13.要使K2S溶液中$\frac{c({K}^{+})}{c({S}^{2-})}$的比值变大,可加入适量的物质是( )
| A. | 盐酸 | B. | KHS溶液 | C. | NaOH溶液 | D. | Na2S溶液 |
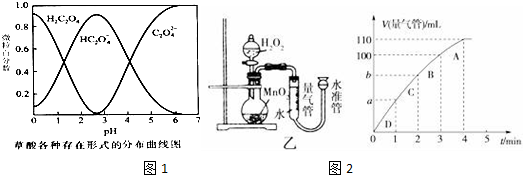
20.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素.实验条件作如下限定:
所用酸性KMnO4溶液的浓度可选择0.010mol•L-1、0.0010mol•L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.10mol•L-1)的用量均为2mL.
(1)已知草酸溶液中各种微粒存在形式的分布曲线图如图1,请写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(3)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
①实验Ⅱ中用KMnO4的浓度变化来表示的平均反应速率为1×10-4mol•L-1•min-1(忽略混合前后溶液的体积变化).
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应
(4)该反应的催化剂选择MnCl2还是MnSO4并简述选择的理由:MnSO4,如选用MnCl2,则酸性高锰酸钾会与Cl-反应,而且引入了Cl-无法证明是Mn2+起了催化作用
(5)化学催化剂有很多,在生产和科技领域起到重大作用.探究小组又利用乙装置探究MnO2对H2O2分解的催化效果.将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如图2所示.
①实验时放出气体的总体积是110mL.
②b小于(填“大于”“小于”或“等于”)90mL.
所用酸性KMnO4溶液的浓度可选择0.010mol•L-1、0.0010mol•L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.10mol•L-1)的用量均为2mL.
(1)已知草酸溶液中各种微粒存在形式的分布曲线图如图1,请写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.

(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③ 探究温度对反应速率的影响; c.实验①和④ 探究催化剂对反应速率的影响. |
| ② | ||||
| ③ | 0.010 | |||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| Ⅰ | 14.0 | 13.0 | 11.0 |
| Ⅱ | 6.5 | 6.7 | 6.8 |
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应
(4)该反应的催化剂选择MnCl2还是MnSO4并简述选择的理由:MnSO4,如选用MnCl2,则酸性高锰酸钾会与Cl-反应,而且引入了Cl-无法证明是Mn2+起了催化作用
(5)化学催化剂有很多,在生产和科技领域起到重大作用.探究小组又利用乙装置探究MnO2对H2O2分解的催化效果.将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如图2所示.
①实验时放出气体的总体积是110mL.
②b小于(填“大于”“小于”或“等于”)90mL.
9.下列说法中不正确的是( )
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | Na2CO3溶液比NaHCO3溶液碱性强 | |
| D. | 碳酸钠与盐酸反应放出二氧化碳的剧烈程度强于碳酸氢钠 |
 .
.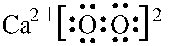 ;加热过氧化钙可分解生成CaO和O2,该反应的化学方程式为2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑.
;加热过氧化钙可分解生成CaO和O2,该反应的化学方程式为2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑.