题目内容
 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=QkJ/mol
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=QkJ/mol(1)判断该可逆反应达到平衡状态的标志是(填字母序号)
a、生成CH3OH的速率与消耗CO的速率相等
b、混合气体的密度不变
c、混合气体的平均相对分子质量不变
d、CH3OH、CO、H2的浓度都不再发生变化
(2)如表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2mol?L-1,此时对应的温度为
(3)请在图中画出压强不同,平衡时甲醇的体积分数(φ)随温度(T)变化的两条曲线(在曲线上标出P1、P2、,且p1<P2)
(4)要提高CO的转化率,可以采取的措施是
a、升温 b、加入催化剂 c、增加CO的浓度 d、通入H2加压账 e、通人惰性气体加压 f、电离出甲醇
(5)已知一定条件下,CO与H2在催化剂的作用下生成5mol CH3OH时,能量的变化为454kJ.在该条件下,向容积相同的3个密闭容器中,按照甲、乙、丙三种不同的投料方式加人反应物,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1mol CO 2mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应吸收或放出的能量(KJ) | a | b | c | |
| 体系压强(Pa) | P1 | P2 | P3 | |
| 反应物转化率 | α1 | α2 | α3 | |
A、2c1>c3 B、a+b<90.8 C、2P2<P3 D、α1+α3<1.
考点:等效平衡,化学平衡的影响因素,化学平衡状态的判断,产物的百分含量随浓度、时间的变化曲线
专题:化学平衡专题
分析:(1)a、CH3OH的生成速率与CO的消耗速率都表示正反应速率;
b、都为气体,容器的体积不变,混合气体的总质量不变,密度自始至终为定值;
c、混合气体的总质量不变,随反应进行,混合气体的总的物质的量减小,即平均相对分子质量减小,最后为定值;
d、可逆反应得到平衡,反应混合物的浓度、含量为定值;
(2)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动;
②计算平衡时CO的物质的量,n开始(CO)-n平衡(CO)=n转化(CO),利用转化率定义计算CO的转化率;
计算该温度下的平衡常数,对比表中数据判断温度;
(3)根据外界条件对化学平衡的影响,主要受温度和压强的影响可以作出图;
(4)要提高CO的转化率,平衡应向正反应移动,据此结合选项分析判断.注意若只增大CO浓度,平衡向正反应移动,CO的转化率降低;
(5)甲和乙为等效平衡,丙的起始物质的量为甲乙的双倍,根据压强对平衡的影响可以判断.
b、都为气体,容器的体积不变,混合气体的总质量不变,密度自始至终为定值;
c、混合气体的总质量不变,随反应进行,混合气体的总的物质的量减小,即平均相对分子质量减小,最后为定值;
d、可逆反应得到平衡,反应混合物的浓度、含量为定值;
(2)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动;
②计算平衡时CO的物质的量,n开始(CO)-n平衡(CO)=n转化(CO),利用转化率定义计算CO的转化率;
计算该温度下的平衡常数,对比表中数据判断温度;
(3)根据外界条件对化学平衡的影响,主要受温度和压强的影响可以作出图;
(4)要提高CO的转化率,平衡应向正反应移动,据此结合选项分析判断.注意若只增大CO浓度,平衡向正反应移动,CO的转化率降低;
(5)甲和乙为等效平衡,丙的起始物质的量为甲乙的双倍,根据压强对平衡的影响可以判断.
解答:
解:(1)a、CH3OH的生成速率与CO的消耗速率都表示正反应速率,自始至终反应速率都按1:1进行,不能说明到达平衡,故a错误;
b、都为气体,容器的体积不变,混合气体的总质量不变,密度自始至终为定值,不能说明可逆反应到达平衡,故b错误;
c、混合气体的总质量不变,随反应进行,混合气体的总的物质的量减小,即平均相对分子质量减小,最后为定值,说明可逆反应到达平衡状态,故c正确;
d、CH3OH、CO、H2的浓度都不再发生变化,说明可逆反应到达平衡状态,故d正确.
故选:cd;
(2)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,
平衡时CO的物质的量为0.2mol/L×2L=0.4mol,所以CO的转化率为
×100%=80%;
对于可逆反应:CO(g)+2H2(g)?CH3OH(g)
开始(mol/L):1 3 0
变化(mol/L):0.8 1.6 0.8
平衡(mol/L):0.2 1.4 0.8
所以该温度下平衡常数k=
=2.041,平衡常数只受温度影响,故该温度为250℃.
故答案为:250℃;80%;
(3)因为该反应为气体体积减小且放热的反应,所以温度升高平衡逆向移动,增大压强平衡正向移动,据此可以画出图为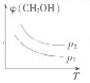 ,
,
故答案为: ;
;
(4)a.升高温度,平衡向逆反应移动,平衡时CO的转化率减小,故a错误;
b.加入催化剂,缩短到达平衡时间,平衡不移动,CO转化率不变,故b错误;
c.增加CO的浓度,平衡向正反应移动,平衡时CO的转化率减小,故c错误;
d.加入H2加压,平衡向正反应移动,平衡时CO的转化率增大,故d正确;
e.加入惰性气体加压,反应混合物的浓度不变,变化不移动,故e错误;
f.分离出甲醇,平衡向正反应移动,平衡时CO的转化率增大,故f正确.
故选:df;
(5)A、丙的物质的量为甲的物质的量折算后的双倍,压强增大,平衡正向移动,所以2c1<c3 ,故A错误;
B、生成5mol CH3OH时,能量的变化为454kJ,则生成1mol甲醇,会放出90.8kJ的热,甲和乙是从不同方向进行的等效平衡,所以有a+b=90.8,故B错误;
C、丙的物质的量为乙的物质的量的双倍,压强增大,平衡向体积减小的方向移动,所以2P2>P3,故C错误;
D、丙的压强大于甲,平衡正向移动,甲醇的转化率减小,所以α1+α3<1,故D正确;
故选D.
b、都为气体,容器的体积不变,混合气体的总质量不变,密度自始至终为定值,不能说明可逆反应到达平衡,故b错误;
c、混合气体的总质量不变,随反应进行,混合气体的总的物质的量减小,即平均相对分子质量减小,最后为定值,说明可逆反应到达平衡状态,故c正确;
d、CH3OH、CO、H2的浓度都不再发生变化,说明可逆反应到达平衡状态,故d正确.
故选:cd;
(2)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,
平衡时CO的物质的量为0.2mol/L×2L=0.4mol,所以CO的转化率为
| 2mol-0.4mol |
| 2mol |
对于可逆反应:CO(g)+2H2(g)?CH3OH(g)
开始(mol/L):1 3 0
变化(mol/L):0.8 1.6 0.8
平衡(mol/L):0.2 1.4 0.8
所以该温度下平衡常数k=
| 0.8 |
| 0.2×1.42 |
故答案为:250℃;80%;
(3)因为该反应为气体体积减小且放热的反应,所以温度升高平衡逆向移动,增大压强平衡正向移动,据此可以画出图为
 ,
,故答案为:
 ;
;(4)a.升高温度,平衡向逆反应移动,平衡时CO的转化率减小,故a错误;
b.加入催化剂,缩短到达平衡时间,平衡不移动,CO转化率不变,故b错误;
c.增加CO的浓度,平衡向正反应移动,平衡时CO的转化率减小,故c错误;
d.加入H2加压,平衡向正反应移动,平衡时CO的转化率增大,故d正确;
e.加入惰性气体加压,反应混合物的浓度不变,变化不移动,故e错误;
f.分离出甲醇,平衡向正反应移动,平衡时CO的转化率增大,故f正确.
故选:df;
(5)A、丙的物质的量为甲的物质的量折算后的双倍,压强增大,平衡正向移动,所以2c1<c3 ,故A错误;
B、生成5mol CH3OH时,能量的变化为454kJ,则生成1mol甲醇,会放出90.8kJ的热,甲和乙是从不同方向进行的等效平衡,所以有a+b=90.8,故B错误;
C、丙的物质的量为乙的物质的量的双倍,压强增大,平衡向体积减小的方向移动,所以2P2>P3,故C错误;
D、丙的压强大于甲,平衡正向移动,甲醇的转化率减小,所以α1+α3<1,故D正确;
故选D.
点评:本题考查平衡状态判断、平衡移动、平衡常数、热化学方程式、化学平衡图象等,是化学反应速率与化学平衡的综合题目,难度不大,注重基础知识的考查.

练习册系列答案
相关题目
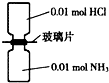 NA表示阿伏加德罗常数的值,常温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )
NA表示阿伏加德罗常数的值,常温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )| A、反应前气体的总体积为0.448L |
| B、生成物中含有0.01NA个分子 |
| C、装置中氢元素的总质量为0.04g |
| D、生成物完全溶于水后所得溶液含有0.01NA个NH4+ |
在给定条件的水溶液中一定能大量共存的离子组是( )
| A、含有SO42-的溶液:Ca2+、NH4+、HCO3-、Cl- |
| B、c(Fe2+)=0.5 mol/L的溶液:H+、Na+、Cl-、SO42- |
| C、pH=1的溶液:Na+、K+、Cl-、CO32- |
| D、酸性无色透明溶液中:Fe2+、Na+、NO3-、CO32- |
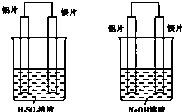 有甲和乙两位同学均想利用原电池反应来检测金属的活动性顺序,两人都使用镁片和铝片作电极,但甲同学将电极放到6mol?L-1 H2SO4溶液中,乙同学将电极放到6mol?L-1NaOH溶液中,如图所示:
有甲和乙两位同学均想利用原电池反应来检测金属的活动性顺序,两人都使用镁片和铝片作电极,但甲同学将电极放到6mol?L-1 H2SO4溶液中,乙同学将电极放到6mol?L-1NaOH溶液中,如图所示: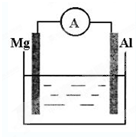 如图所示,组成一个原电池.
如图所示,组成一个原电池.