题目内容
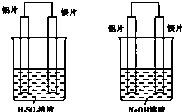 有甲和乙两位同学均想利用原电池反应来检测金属的活动性顺序,两人都使用镁片和铝片作电极,但甲同学将电极放到6mol?L-1 H2SO4溶液中,乙同学将电极放到6mol?L-1NaOH溶液中,如图所示:
有甲和乙两位同学均想利用原电池反应来检测金属的活动性顺序,两人都使用镁片和铝片作电极,但甲同学将电极放到6mol?L-1 H2SO4溶液中,乙同学将电极放到6mol?L-1NaOH溶液中,如图所示:请回答:
(1)写出甲池中正极的电极反应式:
(2)写出乙池中负极的电极反应式和总反应的离子方程式.负极:
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出
(4)由此实验,可得到如下哪些正确结论?
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动顺序表已过时,已没有应用价值
d.该实验说明化学研究对象复杂,反应受条件的影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序表判断电池中的正负极”的这种说法
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;
(2)乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应;
(3)根据作负极的金属活泼性强结合电池中的负极判断;
(4)A、原电池正负极与电解质溶液有关;
B、镁的金属性大于铝;
C、金属活动顺序表是科学合理的;
D、该实验说明化学研究对象复杂,因此应具体问题具体分析;
(5)可以通过测电流的方向来判断原电池的正负极.
(2)乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应;
(3)根据作负极的金属活泼性强结合电池中的负极判断;
(4)A、原电池正负极与电解质溶液有关;
B、镁的金属性大于铝;
C、金属活动顺序表是科学合理的;
D、该实验说明化学研究对象复杂,因此应具体问题具体分析;
(5)可以通过测电流的方向来判断原电池的正负极.
解答:
解:(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,正极反应为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应,电极反应式为Al+4OH--3e-=AlO2-+2H2O,总反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,
故答案为:Al+4OH--3e-=AlO2-+2H2O;2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;
(3)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强,故答案为:Mg;Al;
(4)a、根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故a正确;
b、镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故b错误;
c、该实验对研究物质的性质有实用价值,故c错误;
d、该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故d正确;
故选ad;
(5)上述实验说明,“直接利用金属活动性顺序表判断电池中的正负极”并不考可靠,最好是接一个电流计,通过观察电流方向判断原电池的正负极,
故答案为:不可靠;在两电极之间连上一个电流计测电流方向,判断原电池的正负极.
(2)乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应,电极反应式为Al+4OH--3e-=AlO2-+2H2O,总反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,
故答案为:Al+4OH--3e-=AlO2-+2H2O;2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;
(3)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强,故答案为:Mg;Al;
(4)a、根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故a正确;
b、镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故b错误;
c、该实验对研究物质的性质有实用价值,故c错误;
d、该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故d正确;
故选ad;
(5)上述实验说明,“直接利用金属活动性顺序表判断电池中的正负极”并不考可靠,最好是接一个电流计,通过观察电流方向判断原电池的正负极,
故答案为:不可靠;在两电极之间连上一个电流计测电流方向,判断原电池的正负极.
点评:本题考查了探究原电池原理,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极,为易错点.

练习册系列答案
相关题目
将盛满NO2和O2混合气体的试管倒立于水中,经过足够长的时间后,试管内气体体积缩小为原体积的一半,则剩余气体的成分是( )
| A、NO或O2 |
| B、NO |
| C、O2 |
| D、NO2 |
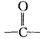 官能团.
官能团. 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=QkJ/mol
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=QkJ/mol