题目内容
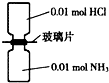 NA表示阿伏加德罗常数的值,常温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )
NA表示阿伏加德罗常数的值,常温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )| A、反应前气体的总体积为0.448L |
| B、生成物中含有0.01NA个分子 |
| C、装置中氢元素的总质量为0.04g |
| D、生成物完全溶于水后所得溶液含有0.01NA个NH4+ |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:氨气与氯化氢反应:HCl+NH3=NH4Cl,生成0.01mol氯化铵固体.
A.常温常压下,气体摩尔体积不是22.4L/mol;
B.生成物为氯化铵,为离子化合物,不存在分子;
C.装置中n(H)=n(HCl)+3n(NH3),再根据m=nM计算;
D.铵根离子是弱碱阳离子,在水溶液中水解.
A.常温常压下,气体摩尔体积不是22.4L/mol;
B.生成物为氯化铵,为离子化合物,不存在分子;
C.装置中n(H)=n(HCl)+3n(NH3),再根据m=nM计算;
D.铵根离子是弱碱阳离子,在水溶液中水解.
解答:
解:氨气与氯化氢反应:HCl+NH3=NH4Cl,生成0.01mol氯化铵固体.
A.常温常压下,气体摩尔体积不是22.4L/mol,大于22.4L/mol,故反应前气体的总体积>(0.01mol+0.01mol)×22.4L/mol=0.448L,故A错误;
B.生成物为氯化铵,为离子化合物,不存在分子,故B错误;
C.装置中n(H)=n(HCl)+3n(NH3)=0.01mol+0.01mol×3=0.04mol,故氢元素质量=0.04mol×1g/mol=0.04g,故C正确;
D.0.01molHCl和0.01molNH3恰好反应,生成的氯化铵为0.01mol,铵根离子是弱碱阳离子,在水溶液中发生水解,加水溶解后所得溶液中NH4+数目小于0.01 NA,故D错误;
故选C.
A.常温常压下,气体摩尔体积不是22.4L/mol,大于22.4L/mol,故反应前气体的总体积>(0.01mol+0.01mol)×22.4L/mol=0.448L,故A错误;
B.生成物为氯化铵,为离子化合物,不存在分子,故B错误;
C.装置中n(H)=n(HCl)+3n(NH3)=0.01mol+0.01mol×3=0.04mol,故氢元素质量=0.04mol×1g/mol=0.04g,故C正确;
D.0.01molHCl和0.01molNH3恰好反应,生成的氯化铵为0.01mol,铵根离子是弱碱阳离子,在水溶液中发生水解,加水溶解后所得溶液中NH4+数目小于0.01 NA,故D错误;
故选C.
点评:本题考查物质的量有关计算、气体摩尔体积、盐类水解等,题目难度中等,B选项为易错点,学生容易忽略氯化铵为离子化合物,氯化铵不存在分子.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
将盛满NO2和O2混合气体的试管倒立于水中,经过足够长的时间后,试管内气体体积缩小为原体积的一半,则剩余气体的成分是( )
| A、NO或O2 |
| B、NO |
| C、O2 |
| D、NO2 |
阿司匹林是一种常见药物,它的相对分子质量为180,含碳、氢、氧三种元素,其中碳、氢的质量数分别是60%、4.4%,则阿司匹林的分子式是( )
| A、C10H9O4 |
| B、C 10H22O3 |
| C、C9H10O4 |
| D、C9H8O4 |
取含有 0.02mol 的硫酸溶液,先投入 0.24g 镁粉,再滴入NaOH 溶液,当使溶液中的镁离子全部转化为沉淀时,需要NaOH的物质的量为( )
| A、0.02mol |
| B、0.03mol |
| C、0.04mol |
| D、0.01mol |
 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=QkJ/mol
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=QkJ/mol