题目内容
 某化学兴趣小组拟用如图装置测定某粗锌样品中锌的质量分数.他们查阅资料后获知该粗锌样品中的其他成分不能与稀盐酸反应.请填写以下实验报告.
某化学兴趣小组拟用如图装置测定某粗锌样品中锌的质量分数.他们查阅资料后获知该粗锌样品中的其他成分不能与稀盐酸反应.请填写以下实验报告.(1)实验目的:
(2)实验步骤:
①称取10.0g粗锌置于铜网中,按图示装置组装后,称得仪器和药品总质量为120.0g.
②将铜网插入足量的稀盐酸中,有关反应的化学方程式为
③反应完全后,称得装置总质量为119.8g,则粗锌中锌的质量分数为
(3)问题探究:(已知碱石灰是NaOH和CaO的混合物,常用于干燥、吸收气体.)
①该实验若不用碱石灰,则所测得的粗锌中锌的质量分数将
②若将粗锌换成某含有杂质的石灰石样品(杂质也不与稀盐酸反应),判断该实验方案能不能用于石灰石样品中CaCO3质量分数的测定,并说明理由.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据题目信息和实验所测数据分析实验目的;
(2)锌和盐酸反应生成氯化锌和氢气;反应前后装置的质量差是氢气的质量,再利用方程式求解即可;
(3)①碱石灰能吸收水蒸气与氯化氢气体,这样可使氢气的质量更准确一些;没有碱石灰,会导致氢气质量增大,算出的锌的质量也会增大,使结果偏大;
②碳酸钙和盐酸生成二氧化碳,二氧化碳能与碱石灰反应,使产生气体的质量无法测量,所以该实验不可行.
(2)锌和盐酸反应生成氯化锌和氢气;反应前后装置的质量差是氢气的质量,再利用方程式求解即可;
(3)①碱石灰能吸收水蒸气与氯化氢气体,这样可使氢气的质量更准确一些;没有碱石灰,会导致氢气质量增大,算出的锌的质量也会增大,使结果偏大;
②碳酸钙和盐酸生成二氧化碳,二氧化碳能与碱石灰反应,使产生气体的质量无法测量,所以该实验不可行.
解答:
解:(1)根据题目信息和实验所测数据,可知该实验是要测定粗锌样品中锌的质量分数(或纯度);
故答案为:测定粗锌样品中锌的质量分数(或纯度);
(3)②锌和盐酸反应生成氯化锌和氢气,依据方程式的书写方法,方程式为:Zn+2HCl=ZnCl2+H2↑;
故答案为:Zn+2HCl=ZnCl2+H2↑
③根据化学反应,反应前后只有氢气可以出去,因此氢气的质量=120g-119.8g=0.2g.
设生成0.2克氢气需要锌的质量是X.
Zn+2HCl=ZnCl2+H2↑
65 2
X 0.2g
X=6.5g
×100%═65%.
故答案为:65%;
(3)①碱石灰能吸收水蒸气与氯化氢气体,这样不会使其散出从而不会影响氢气的质量,去掉它会使氢气的计算值变大,导致计算出的锌变大纯度也偏大;
故答案为:偏大;
②二氧化碳能与碱石灰反应,使产生气体的质量无法测量,从而无法求出碳酸钙的质量,所以该实验不可行;
故答案为:不能;碱石灰能吸收反应生成的CO2.
故答案为:测定粗锌样品中锌的质量分数(或纯度);
(3)②锌和盐酸反应生成氯化锌和氢气,依据方程式的书写方法,方程式为:Zn+2HCl=ZnCl2+H2↑;
故答案为:Zn+2HCl=ZnCl2+H2↑
③根据化学反应,反应前后只有氢气可以出去,因此氢气的质量=120g-119.8g=0.2g.
设生成0.2克氢气需要锌的质量是X.
Zn+2HCl=ZnCl2+H2↑
65 2
X 0.2g
X=6.5g
| 6.5g |
| 10.0g |
故答案为:65%;
(3)①碱石灰能吸收水蒸气与氯化氢气体,这样不会使其散出从而不会影响氢气的质量,去掉它会使氢气的计算值变大,导致计算出的锌变大纯度也偏大;
故答案为:偏大;
②二氧化碳能与碱石灰反应,使产生气体的质量无法测量,从而无法求出碳酸钙的质量,所以该实验不可行;
故答案为:不能;碱石灰能吸收反应生成的CO2.
点评:本题是一道综合性较强的实验题,解题时抓住质量守恒这一主线进行了分析与探讨并进行相关计算,能很好的训练学生思维与分析问题能力,题目难度中等.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
有体积相同,pH相等的烧碱溶液和氨水,下列叙述中正确的是( )
| A、两溶液溶质物质的量浓度相同 |
| B、用同浓度的盐酸中和时,消耗盐酸的体积相同 |
| C、两溶液中OH-离子浓度相同 |
| D、加入等体积的水稀释后,它们的pH仍相等 |
下列说法正确的是( )
| A、不能跟碱反应的氧化物一定能和酸反应 |
| B、溶液和胶体的本质区别在于分散质粒子的直径大小不同 |
| C、58.5gNaCl固体溶于1L水所得溶液中NaCl的物质的量浓度为l mol?L-1 |
| D、将SO2通入滴有酚酞的NaOH溶液中,溶液红色消失,说明SO2具有漂白性 |
 如图的电解池中,a、b、c、d都是石墨电极,通电一段时间后,a、b、c、d各电极上生成物物质的量之比是( )
如图的电解池中,a、b、c、d都是石墨电极,通电一段时间后,a、b、c、d各电极上生成物物质的量之比是( )| A、2:2:4:1 |
| B、1:1:2:1 |
| C、2:4:4:1 |
| D、2:1:2:1 |
对氯化铁溶液和氢氧化铁胶体的说法正确的是( )
| A、分散系颗粒直径都在1~100nm之间 |
| B、能透过半透膜 |
| C、呈红褐色 |
| D、用丁达尔效应可以鉴别 |
 苯胺易被氧化)
苯胺易被氧化)

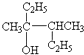
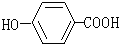
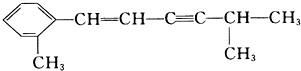 该分子中最多有
该分子中最多有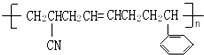 ,这三种单体的结构简式分别是
,这三种单体的结构简式分别是