题目内容
某同学在学习氯气与铁粉反应时认为:当Cl2足量时生成FeCl3,当铁粉过量时是FeCl2,为验证该观点是否正确,该同学将一定量铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分.探究过程如下:请填空:
(1)提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是
假设3:该固体物质是
(2)设计方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式
(4)取100mL0.2mol/L FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是 (设溶液体积不变)
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L
B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,c(Cl-)=0.6mol/L
D.烧杯中有Fe、Cu均有,c(Fe2+)=0.3mol/L.
(1)提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是
假设3:该固体物质是
(2)设计方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加KSCN溶液 | 固体物质中有FeCl3 | |
| 在KMnO4溶液中加少量A溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 |
(4)取100mL0.2mol/L FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L
B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,c(Cl-)=0.6mol/L
D.烧杯中有Fe、Cu均有,c(Fe2+)=0.3mol/L.
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或二者的混合物;
(2)固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质;
(3)氯气和铁反应生成氯化铁;
(4)A、铁还原性大于铜,铁有剩余,一定有铜剩余;
B、有铜无铁,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,溶液中铁离子不存在;
C、溶液中氯离子浓度不变;
D、溶液中铁铜都有,说明铁离子和铁反应生成亚铁离子;
(2)固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质;
(3)氯气和铁反应生成氯化铁;
(4)A、铁还原性大于铜,铁有剩余,一定有铜剩余;
B、有铜无铁,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,溶液中铁离子不存在;
C、溶液中氯离子浓度不变;
D、溶液中铁铜都有,说明铁离子和铁反应生成亚铁离子;
解答:
解:(1)根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或FeCl3和FeCl2的混合物,
故答案为:FeCl3;FeCl3和FeCl2;
(2)固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质,即不含FeCl2,
故答案为:溶液变红色;FeCl2;
(3)依据实验现象判断,氯气和铁反应生成氯化铁,Cl2与铁粉加热时发生反应的化学方程式:2Fe+3Cl2
2FeCl3,
故答案为:2Fe+3Cl2
2FeCl3;
(4)A、铁还原性大于铜,铁有剩余,一定有铜剩余,只发生2Fe3++Fe=3Fe2+,依据铁离子物质的量0.02mol生成亚铁离子0.03mol,亚铁离子浓度c(Fe2+)=0.3mol/L,故A错误;
B、有铜无铁,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,当铜部分反应时,所以反应为2Fe3++Fe=3Fe2+,2Fe3++Cu=Cu2++2Fe2+,依据铁离子物质的量0.02mol则生成亚铁离子小于0.03mol,亚铁离子浓度c(Fe2+)小于0.3mol/L,故B错误;
C、溶液中氯离子浓度不变,烧杯中有Cu无Fe,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,溶液中铁离子不存在,溶液中c(Cl-)=0.6mol/L,故C正确;
D、溶液中铁铜都有,说明只发生2Fe3++Fe=3Fe2+,烧杯中Fe、Cu均有,说明铁离子全部反应,依据A计算得到c(Fe2+)=0.3mol/L,故D正确;
故选CD;
故答案为:FeCl3;FeCl3和FeCl2;
(2)固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质,即不含FeCl2,
故答案为:溶液变红色;FeCl2;
(3)依据实验现象判断,氯气和铁反应生成氯化铁,Cl2与铁粉加热时发生反应的化学方程式:2Fe+3Cl2
| ||
故答案为:2Fe+3Cl2
| ||
(4)A、铁还原性大于铜,铁有剩余,一定有铜剩余,只发生2Fe3++Fe=3Fe2+,依据铁离子物质的量0.02mol生成亚铁离子0.03mol,亚铁离子浓度c(Fe2+)=0.3mol/L,故A错误;
B、有铜无铁,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,当铜部分反应时,所以反应为2Fe3++Fe=3Fe2+,2Fe3++Cu=Cu2++2Fe2+,依据铁离子物质的量0.02mol则生成亚铁离子小于0.03mol,亚铁离子浓度c(Fe2+)小于0.3mol/L,故B错误;
C、溶液中氯离子浓度不变,烧杯中有Cu无Fe,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,溶液中铁离子不存在,溶液中c(Cl-)=0.6mol/L,故C正确;
D、溶液中铁铜都有,说明只发生2Fe3++Fe=3Fe2+,烧杯中Fe、Cu均有,说明铁离子全部反应,依据A计算得到c(Fe2+)=0.3mol/L,故D正确;
故选CD;
点评:本题考查了反应类推方法的应用,反应产物实验设计的应用,反应现象的判断,实验方案的设计,铁、铜、氯化铁溶液共存问题的分析判断离子浓度的计算,题目难度中等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
下列关于电解质溶液的正确判断是( )
| A、由0.1mol/l一元碱HA溶液的pH=3,可推知NaA溶液存在A-+H2O?HA+OH- |
| B、在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 |
| C、由0.1 mol/l一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- |
| D、在pH=12的溶液中,K+、CL-、HCO3-、Na+可以大量共存 |
下列各溶液中,微粒的物质的量浓度关系或说法不正确的是( )
| A、0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B、0.1mol/L NH4Cl溶液:c(NH4+)<c(Cl-) |
| C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、常温下物质的量浓度相等①NH4HSO4、②(NH4)2SO4、③(NH4)2CO3三种溶液中c(NH4+):①<②<③ |
 有机物A可发生如下转化:
有机物A可发生如下转化: 某化学兴趣小组拟用如图装置测定某粗锌样品中锌的质量分数.他们查阅资料后获知该粗锌样品中的其他成分不能与稀盐酸反应.请填写以下实验报告.
某化学兴趣小组拟用如图装置测定某粗锌样品中锌的质量分数.他们查阅资料后获知该粗锌样品中的其他成分不能与稀盐酸反应.请填写以下实验报告.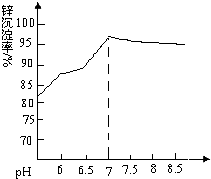 纳米氧化锌是一种新型高功能精细无机产品,由粗氧化锌(含杂质Al2O3、FeO、Fe2O3、CuO等)制备纳米氧化锌.流程依次涉及的部分离子方程式:①FeO+2H+=Fe2++H2O ②H2O2+2Fe2++2H+=2Fe3++2H2O ③Zn+Cu2+=Zn2++Cu
纳米氧化锌是一种新型高功能精细无机产品,由粗氧化锌(含杂质Al2O3、FeO、Fe2O3、CuO等)制备纳米氧化锌.流程依次涉及的部分离子方程式:①FeO+2H+=Fe2++H2O ②H2O2+2Fe2++2H+=2Fe3++2H2O ③Zn+Cu2+=Zn2++Cu

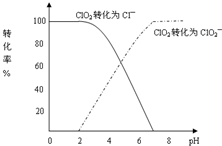 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg?L-1.饮用水中CIO2、CIO2-的含量可用连续碘量法进行测定.CIO2被I-还原为CIO2-、Cl-的转化率与溶液pH的关系如图所示.当pH≤2.0时,CIO2-也能被I-完全还原成Cl-.反应生成的I2用标准Na2S2O3溶液滴定:
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg?L-1.饮用水中CIO2、CIO2-的含量可用连续碘量法进行测定.CIO2被I-还原为CIO2-、Cl-的转化率与溶液pH的关系如图所示.当pH≤2.0时,CIO2-也能被I-完全还原成Cl-.反应生成的I2用标准Na2S2O3溶液滴定: