题目内容
下列各个曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:

(1)ⅡA族元素的最外层电子数 ;
(2)第3周期元素的最高化合价 ;
(3)F-、Na+、Mg2+、Al3+的离子半径 .

(1)ⅡA族元素的最外层电子数
(2)第3周期元素的最高化合价
(3)F-、Na+、Mg2+、Al3+的离子半径
考点:同一周期内元素性质的递变规律与原子结构的关系
专题:元素周期律与元素周期表专题
分析:(1)根据同一主族元素的最外层电子数相等;
(2)第3周期的最高化合价从左→右依次升高;
(3)四种离子有相同的电子层结构,核电荷数越小,离子半径越大.
(2)第3周期的最高化合价从左→右依次升高;
(3)四种离子有相同的电子层结构,核电荷数越小,离子半径越大.
解答:
解:(1)ⅡA族元素的最外层电子数相等,图象b符合,故答案为:b;
(2)第3周期的最高化合价从左→右依次升高,图象c符合,故答案为:c;
(3)四种离子有相同的电子层结构,核电荷数越小,离子半径越大,故离子半径:F->Na+>Mg2+>Al3+,图象a符合,故答案为:a.
(2)第3周期的最高化合价从左→右依次升高,图象c符合,故答案为:c;
(3)四种离子有相同的电子层结构,核电荷数越小,离子半径越大,故离子半径:F->Na+>Mg2+>Al3+,图象a符合,故答案为:a.
点评:本题考查元素周期表、元素周期律、微粒半径比较,比较基础,侧重对基础知识的巩固.

练习册系列答案
相关题目
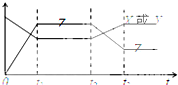 现有反应X(g)+Y(g)?2Z(g),△H<0.如图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡,则在图中t2s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g),△H<0.如图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡,则在图中t2s时改变的条件可能是( )| A、增大了X或Y的浓度 |
| B、增大压强 |
| C、增大Z的浓度 |
| D、升高温度 |
用酸性氢氧燃料电池为电源进行电解的实验装置如图所示,下列说法正确的是( )

| A、燃料电池工作时,正极反应为:O2+2H2O+4e-═4OH- |
| B、在溶液中SO42-往b极移动 |
| C、若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
| D、若a极是铜,b极是铁时,a极逐渐溶解,b极上有铜析出 |
 采用MnO2作H2O2分解的催化剂,如图所示,测量收集到的氧气是实验的关键,你认为应该注意哪几个问题?
采用MnO2作H2O2分解的催化剂,如图所示,测量收集到的氧气是实验的关键,你认为应该注意哪几个问题?