题目内容
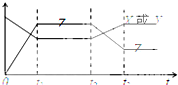 现有反应X(g)+Y(g)?2Z(g),△H<0.如图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡,则在图中t2s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g),△H<0.如图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡,则在图中t2s时改变的条件可能是( )| A、增大了X或Y的浓度 |
| B、增大压强 |
| C、增大Z的浓度 |
| D、升高温度 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:从t2秒后X或Y的浓度增大,Z的浓度减小,说明平衡向逆反应方向移动,改变条件的瞬间,浓度不变,根据反应的特点和外界条件对平衡的影响来判断.
解答:
解:A.t2到t3X或Y的浓度增大,Z的浓度减小,若增大X或Y的浓度,平衡正反应方向移动,Z的浓度应增大,且改变条件的瞬间,浓度不变,不符合,故D错误;
B.增大了体系压强,平衡不移动,改变条件瞬间X、Y、Z的浓度应增大,故B错误;
C.增大Z的浓度,平衡逆向进行,X或Y的浓度增多,平衡状态Z浓度大于原平衡状态,故C错误;
D、该反应放热,升高该反应的温度,平衡逆反应方向移动,X或Y的浓度增多,Z的浓度减小,图象符合,故D正确;
故选D.
B.增大了体系压强,平衡不移动,改变条件瞬间X、Y、Z的浓度应增大,故B错误;
C.增大Z的浓度,平衡逆向进行,X或Y的浓度增多,平衡状态Z浓度大于原平衡状态,故C错误;
D、该反应放热,升高该反应的温度,平衡逆反应方向移动,X或Y的浓度增多,Z的浓度减小,图象符合,故D正确;
故选D.
点评:本题考查化学平衡的影响因素,题目难度不大,注意化学方程式的前后计量数的关系以及反应放热的特点,以此判断影响平衡移动的因素.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
下列实验操作或对实验事实的描述正确的是( )
| A、欲将蛋白质从水中析出而又不改变它的性质,应加入CuSO4溶液 |
| B、乙醇可以被氧化为乙酸,二者都能发生酯化反应 |
| C、淀粉溶液中加入一定量稀硫酸,共热一段时间后,向溶液中加入新制氢氧化铜悬浊液并加热煮沸,未见红色固体产生,证明淀粉没有发生水解 |
| D、可用NaOH溶液除去混在乙酸乙酯中的乙酸 |
设NA为阿伏伽德罗常数,则下列说法正确的是( )
A、200ml某硫酸盐中含有1.5NA个SO
| ||
| B、一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为2NA | ||
| C、常温常压下78gNa2O2固体中所含阴、阳离子总数为4NA | ||
| D、电解精炼铜时,若阴极得到电子数为2NA,阳极减少64g |
酸、碱完全中和时,有关说法正确的是( )
| A、溶液一定呈中性 |
| B、酸和碱的物质的量一定相等 |
| C、酸和碱的物质的量浓度相等 |
| D、酸能提供的H+与碱能提供的OH-的物质的量相等 |
可逆反应A(g)+3B(g)?2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是( )
| A、v(A)=0.15mol/(L?min) |
| B、v (B)=0.6 mol/(L?min) |
| C、v (C)=0.3 mol/(L?min) |
| D、v (D)=0.1 mol/(L?min) |
25℃时,由浓度均为1mol?L-1的弱酸(HA)及其盐(NaA)组成的混合溶液.往溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线如图所示.下列说法中,正确的是( )

| A、加NaOH,HA电离平衡常数增大 |
| B、b点溶液中,c(HA)<c(A-) |
| C、溶液中水的电离程度a>b>c |
| D、通入HCl,溶液中阴离子浓度之和减小 |