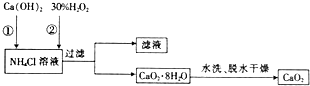
题目内容
20.25℃时,在浓度均为0.1mol•L-1的10mLHCl与CH3COOH混合溶液中,滴加0.1mol•L-1的NaOH溶液.下列有关溶液中粒子浓度关系正确的是( )| A. | 未加NaOH溶液时:c(H+)>c(Cl-)=c(CH3COOH) | |
| B. | 加入l0mLNaOH溶液时:c(CH3COO-)+c(OH-)=c(H+) | |
| C. | 加入20mLNaOH溶液时:c(Na+)=c(CH3COOH)+c(CH3COO一) | |
| D. | 加入20mLNaOH溶液时,酸碱恰好中和:c(OH-)=c(H+) |
分析 A.未加NaOH时,浓度均为0.1mol.L-1的HC1和CH3COOH混合溶液中,盐酸完全电离,醋酸部分电离;
B.加入l0mLNaOH时,酸全部反应,得到等浓度氯化钠和醋酸的混合物,根据溶液中的质子守恒来回答;
C.加入20mLNaOH时,得到的是等浓度的氯化钠、醋酸钠的混合物,根据电荷守恒来回答;
D.恰好反应时生成氯化钠和醋酸钠,醋酸根离子发生水解,溶液呈碱性.
解答 解:A.未加NaOH时,浓度均为0.1mol•L-1的HC1和CH3COOH混合溶液中,盐酸完全电离,醋酸部分电离,c(H+)>c(Cl-)>c(CH3COOH),故A错误;
B.加入l0mLNaOH时,酸全部反应,得到等浓度的氯化钠和醋酸的混合物,氯化钠中钠离子和氯离子浓度相等,溶液中存在质子守恒:c(OH-)+c(CH3COO-)=c(H+),故B正确;
C.加入20mLNaOH时,得到的是等浓度的氯化钠、醋酸钠的混合物,根据物料守恒可得:2c(CH3COOH)+2c(CH3COO-)=c(Na+),故C错误;
D.加入20mLNaOH时,得到的是等浓度的氯化钠、醋酸钠的混合物,醋酸根离子部分水解,溶液呈碱性,则c(OH-)>c(H+),故D错误;
故选B.
点评 本题考查了酸碱混合的定性判断及溶液中离子浓度定性比较,题目难度中等,注意掌握酸碱混合后溶液酸碱性的判断方法,明确电荷守恒、物料守恒的含义,能够根据溶液中守恒关系判断各离子浓度大小,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列关于反应热的说法正确的是( )
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 等量H2在O2中完全燃烧,生成H2O(g)与生成H2O(1)放出的能量相同 | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
11.下列物质中,可能属于同系物的是( )
| A. | C2H4、C3H8 | B. | C2H6、C3H8 | C. | CH4、H2 | D. | C2H2、C3H6 |
8.关于下列各图象的叙述,正确的是( )
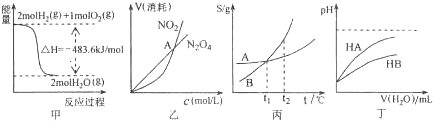

| A. | 甲图表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-1 | |
| B. | 乙图表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙图表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数仍为A%=B% | |
| D. | 丁图表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
15.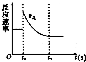 如图表示可逆反应A(g)+3B(g)?2C(g)△H<0达平衡后,t1时改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )
如图表示可逆反应A(g)+3B(g)?2C(g)△H<0达平衡后,t1时改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )
 如图表示可逆反应A(g)+3B(g)?2C(g)△H<0达平衡后,t1时改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )
如图表示可逆反应A(g)+3B(g)?2C(g)△H<0达平衡后,t1时改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )| A. | t1时降低了温度,平衡向正反应方向移动 | |
| B. | t1时增大了压强,平衡向正反应方向移动 | |
| C. | t1时可能使用了催化剂 | |
| D. | t1时增大了A的浓度,同时减小了C的浓度,平衡向正反应方向移动 |
12.下列有关实验操作或说法正确的是( )
| A. | 从试剂瓶中取出的任何药品,若药品有剩余都不能再放回原试剂瓶中 | |
| B. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| C. | 用蒸发的方法,除去酒精溶液中少量的水分 | |
| D. | 用托盘天平称量25.20gNaCl |