题目内容
2.海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.Ⅰ.火力发电燃煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如下图所示:

(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3-+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是2H2SO3+O2═2H2SO4 中和、稀释经氧气氧化后海水中生成的酸.
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.O,ρ≈1g•mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol•L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol/L.
(5)如果用食盐处理其只含Ag+的废水,测得处理后废水中NaCl的质量分数为0.117%.
若环境要求排放标准为c(Ag+)低于1.O×lO-8mol•L-1,问该工厂处理后的废水中c(Ag+)=9×10-9 mol/L.已知Ksp(AgCl)=1.8×l-10mol2•L2.
分析 I(1)海水中的弱酸根离子水解显碱性;
(2)H2SO3或HSO3-中的S显+4价,均可被O2氧化生成H++SO42-,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+);
II(3)溶度积越小越易转化为沉淀,根据表格中的数据进行判断最近试剂;
(4)先计算出溶液中氢氧根离子的物质的量浓度,然后根据Pb(OH)2的溶度积及c(Pb2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$进行计算;
(5)根据氯化银的溶度积进行解答;
解答 解:I(1)天然海水的pH≈8,是因为海水中有CO32-或HCO3-+它们水解使海水呈弱碱性,其离子方程式为CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-;
(2)H2SO3中的S显+4价,均可被O2氧化生成H2SO4,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+),
故答案为:2H2SO3+O2=2H2SO4;中和、稀释经氧气氧化后海水中生成的酸(H+);
II(3)溶度积越小的越易转化为沉淀,由表格中的数据可知,硫化物的溶度积小,则应选择硫化钠,
故答案为:B;
(4)由Pb(OH)2的溶度积为1.2×10-15,pH=8.0,c(OH-)=10-6mol•L-1,则c(Pb2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$=$\frac{1.2×1{0}^{-15}}{(1{0}^{-6})^{2}}$=1.2×10-3mol•L-1,
故答案为:1.2×10-3mol•L-1;
(5)废水中NaCl的质量分数为0.117%(ρ≈1g•mL-1),c(Cl-)=c(NaCl)=$\frac{1000×1g/ml×0.117%}{58.5g/mol}$=0.02mol/L,
Ksp(AgCl)=c(Ag+)•c(Cl-)=1.8×10-10mol2•L-2,则c(Ag+)=$\frac{1.8×1{0}^{-10}}{0.02}$=9×10-9mol•L-1,
故答案为:9×10-9mol•L-1;
点评 本题考查了含硫烟气的处理及难溶物的沉淀转化,利用所学知识结合框图信息是解答本题的关键,难度中等,注意把握Ksp的有关计算的方法.

| A. | 硅 | B. | 二氧化硅 | C. | 硅酸钠 | D. | 硅酸 |

| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
| A. | 常温下所有的金属都是固态 | |
| B. | 金属具有导电、导热和延展性 | |
| C. | 金属元素的原子只有还原性,离子只有氧化性 | |
| D. | 所有金属元素都以化合态存在于自然界 |
| A. | 16g氧气所含的氧原子数为2NA | |
| B. | 18g水所含的电子数为NA | |
| C. | 2.4g金属镁与盐酸(足量)反应失去的电子数为0.1NA | |
| D. | 17g氨气所含电子数目为10NA |
| A. | 金属钠着火时可用水扑灭 | |
| B. | 酒精灯着火时用湿抹布扑盖 | |
| C. | 蒸发结晶时,为得到更多晶体直接将溶液蒸干 | |
| D. |  实验室可分别将贴有标志(a)和标志(b)的药品放在同一橱柜中 |
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| C. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 | |
| D. | 碳酸氢钠可用来治疗胃酸过多 |
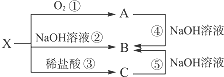 已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化: