题目内容
12.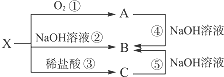 已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:(1)写出下列物质的化学式:XAl,BNaAlO2.
(2)写出以下反应的离子方程式:③2Al+6H+=2Al+3++3H2↑;④Al2O3+2OH-=2AlO2-+H2O.
分析 X是某金属单质,X、A、B、C含同一种元素,由转化关系可知,X与NaOH反应,则X为Al,X与A反应生成A为Al2O3,氧化铝与氢氧化钠反应生成B为NaAlO2,铝与稀盐酸反应生成C为AlCl3,氯化铝与过量的氢氧化钠反应能生成B,符合各物质的转化关系,然后结合物质的性质及化学用语来解答.
解答 解:X是某金属单质,X、A、B、C含同一种元素,由转化关系可知,X与NaOH反应,则X为Al,X与A反应生成A为Al2O3,氧化铝与氢氧化钠反应生成B为NaAlO2,铝与稀盐酸反应生成C为AlCl3,氯化铝与过量的氢氧化钠反应能生成B,符合各物质的转化关系,
(1)由上面的分析可知,X为Al,B为NaAlO2,故答案为:Al;NaAlO2;
(2)反应③为Al和稀盐酸反应生成氯化铝和氢气,反应的离子方程式为:2Al+6H+=2Al+3++3H2↑,
故答案为:2Al+6H+=2Al+3++3H2↑;
反应④为氧化铝与NaOH溶液的反应,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查无机物的推断,为高频考点,综合考查元素化合物知识,把握X与酸碱均反应及氧化物A与碱反应为解答的关键,侧重Al其化合物之间转化反应的考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
Ⅰ.火力发电燃煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如下图所示:

(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3-+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是2H2SO3+O2═2H2SO4 中和、稀释经氧气氧化后海水中生成的酸.
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.O,ρ≈1g•mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol•L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(3)你认为往废水中投入B (填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol/L.
(5)如果用食盐处理其只含Ag+的废水,测得处理后废水中NaCl的质量分数为0.117%.
若环境要求排放标准为c(Ag+)低于1.O×lO-8mol•L-1,问该工厂处理后的废水中c(Ag+)=9×10-9 mol/L.已知Ksp(AgCl)=1.8×l-10mol2•L2.
Ⅰ.火力发电燃煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如下图所示:

(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3-+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是2H2SO3+O2═2H2SO4 中和、稀释经氧气氧化后海水中生成的酸.
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.O,ρ≈1g•mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol•L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol/L.
(5)如果用食盐处理其只含Ag+的废水,测得处理后废水中NaCl的质量分数为0.117%.
若环境要求排放标准为c(Ag+)低于1.O×lO-8mol•L-1,问该工厂处理后的废水中c(Ag+)=9×10-9 mol/L.已知Ksp(AgCl)=1.8×l-10mol2•L2.
3.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | “物质的量”的单位是g.mol-1 | |
| B. | 22.4LN2所含分子数NA | |
| C. | 0.1mol铁与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 0.1mol CO2中所含氧原子数为0.2NA |
20.将含有少量杂质的硝酸铜固体用酒精灯加热至恒重,收集到20.20mL气体,再将该气体用足量水吸收,剩余2.10mL气体(气体体积在同温同压下测定),则关于杂质成分的推测不合理的是( )
| A. | NaNO3 | B. | Mg(NO3)2 | ||
| C. | AgNO3 | D. | NaNO3和AgNO3的混合物 |
7.化学“暖手袋”是充满过饱和醋酸钠溶液的密封塑胶袋,袋内置有一个合金片.当合金片轻微震动使溶质结晶,该过程放热.下列说法不正确的是( )
| A. | 彩色密封塑胶袋能造成白色污染 | |
| B. | 钠、氧化钠、氢氧化钠都能与醋酸反应得到醋酸钠 | |
| C. | 化学变化都伴随着能量的变化 | |
| D. | 大多数合金比各成分金属硬度小,熔点低 |
17.已知氮的氧化物跟NaOH溶液发生的化学反应如下:3NO2+2NaOH═2NaNO3+NO↑+H2O,NO2+NO+2NaOH═2NaNO2+H2O现有m mol NO2和n mol NO组成的混合气体,要用NaOH溶液使其完全吸收无气体剩余,现有浓度为a mol/L的NaOH溶液,则需此NaOH溶液的体积是( )
| A. | $\frac{m}{a}L$ | B. | $\frac{2m}{3a}L$ | C. | $\frac{m+n}{a}L$ | D. | $\frac{2(m+n)}{3a}L$ |
4.分类是学习和研究化学的重要方法,下列分类合理的是( )
| A. | H2SO4和NaHSO4都属于酸 | B. | 火碱和纯碱都属于碱 | ||
| C. | KOH和NH3•H2O都属于电解质 | D. | Na2O和Na2O2都属于碱性氧化物 |
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题: