题目内容
6.往一个容积为5L的密闭容器中,通入2molN2和3molH2,在一定条件下,发生反应 N2+3H2?2NH3,2min后测得容器中生成了1mol NH3,试求:(1)2min时,N2的物质的量1.5mol;
(2)2min时,H2的物质的量浓度0.3mol/L;
(3)2min时,H2的转化率50%;
(4)2min内,N2的平均反应速率0.05mol/(L•min).
分析 依据化学平衡三段式列式计算;
N2 +3H2?2NH3
起始量(mol) 2 3 0
变化量(mol) 0.5 1.5 1
2min末(mol) 1.5 1.5 1
(1)依据计算结果得到氮气物质的量;
(2)物质的量浓度=$\frac{物质的量}{体积}$;
(3)转化率=$\frac{消耗量}{起始量}$×100%;
(4)反应速率v=$\frac{△c}{△t}$计算.
解答 解:N2 +3H2?2NH3
起始量(mol) 2 3 0
变化量(mol) 0.5 1.5 1
2min末(mol) 1.5 1.5 1
(1)依据计算结果得到氮气物质的量为1.5mol,故答案为:1.5mol;
(2)2min时,H2的物质的量浓度=$\frac{1.5mol}{5L}$=0.3mol/L;
(3)2min时,H2的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{1.5mol}{3mol}$×100%=50%,故答案为:50%;
(4)2min内,N2的平均反应速率=$\frac{△c}{△t}$=$\frac{\frac{0.5mol}{5L}}{2min}$=0.05mol/(L•min),故答案为:0.05mol/(L•min).
点评 本题考查了化学平衡三段式计算应用,主要是反应速率、转化率计算分析,注意紧扣公式是解题,题目较简单,关键还是要基础扎实.

练习册系列答案
相关题目
4.下列各组物质中,属于同分异构体的是( )
| A. | 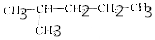 和 和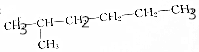 | |
| B. | 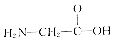 和CH3-CH2-NO2 和CH3-CH2-NO2 | |
| C. | CH3-CH2-CH2-COOH和CH3-CH2-CH2-CH2-COOH | |
| D. | CH3-CH2-O-CH2-CH3和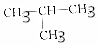 |
1.某同学通过如图所示装置探究铝制品表面出现的白斑,下列说法正确的是( )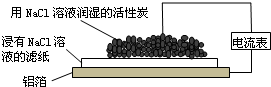

| A. | 铝箔为正极,发生氧化反应而被腐蚀 | |
| B. | 负极反应为2H2O+O2+4e-═4OH- | |
| C. | Cl-由活性炭区向铝箔表面区迁移,铝箔表面有氯气产生 | |
| D. | 白斑的主要成分可能是Al2O3 |
1.以粗氧化锌粉(含FeO、Fe2O3、ZnS等)制取活性ZnO的工艺如下:
步骤1:以H2SO4浸出粗氧化锌,同时加入H2O2;
步骤2:过滤,调节滤液的pH;
步骤3:过滤,向滤液中加NH4HCO3,得碱式碳酸锌沉淀;
步骤4:过滤、洗涤、煅烧,得产品.
已知:离子沉淀的pH见下表.
(1)加入H2O2时能浸出硫化锌,同时生成淡黄色固体,写出其化学方程式ZnS+H2O2+H2SO4=ZnSO4+2H2O+S.
(2)步骤2中调节溶液pH的范围是3.7~5.4.
(3)取洗涤、干燥后的碱式碳酸锌68.2g,充分灼烧后测得残留物质的质量为48.6g,将所得气体通入足量澄清石灰水中,得沉淀20g.计算碱式碳酸锌的组成(用化学式表示,写出计算过程).ZnCO3•2Zn(OH)2•H2O 或Zn3(OH)4CO3•H2O.
步骤1:以H2SO4浸出粗氧化锌,同时加入H2O2;
步骤2:过滤,调节滤液的pH;
步骤3:过滤,向滤液中加NH4HCO3,得碱式碳酸锌沉淀;
步骤4:过滤、洗涤、煅烧,得产品.
已知:离子沉淀的pH见下表.
| 离子 | 开始沉淀pH | 沉淀完全pH |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Zn2+ | 5.4 | 8.0 |
(2)步骤2中调节溶液pH的范围是3.7~5.4.
(3)取洗涤、干燥后的碱式碳酸锌68.2g,充分灼烧后测得残留物质的质量为48.6g,将所得气体通入足量澄清石灰水中,得沉淀20g.计算碱式碳酸锌的组成(用化学式表示,写出计算过程).ZnCO3•2Zn(OH)2•H2O 或Zn3(OH)4CO3•H2O.
11.能正确表示下列反应的离子方程式是( )
| A. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═NH4++HSO3- | |
| B. | 氯化钠固体与浓硫酸混合加热:2H++H2SO4+2Cl-$\frac{\underline{\;△\;}}{\;}$SO2↑+Cl2↑+2H2O | |
| C. | 氧化亚铁溶于稀硝酸:3 Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
18.下列有关物质性质的比较,错误的是( )
| A. | 溶解度:小苏打<苏打 | B. | 沸点:K>Na | ||
| C. | 密度:溴>水 | D. | 热稳定性:HF>HCl |
15.在有机物分子结构的鉴定中常用核磁共振氢谱分析法来测定有机化合物分子( )
| A. | 相对分子质量 | B. | 氢原子在碳骨架上的位置和数目 | ||
| C. | 含有何种化学键或官能团 | D. | 键长、键角及分子的三维结构 |
16.将2.24L(标准状况)乙烯和甲烷的混合气体通入足量的溴水中,充分反应后,溴水的质量增加了2.1g,则原混合气体中乙烯与甲烷的物质的量之比为( )
| A. | 1:1 | B. | 3:1 | C. | 3:2 | D. | 2:3 |
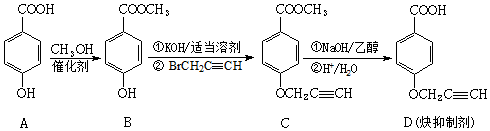
 (中的一种).
(中的一种).