题目内容
1.某同学通过如图所示装置探究铝制品表面出现的白斑,下列说法正确的是( )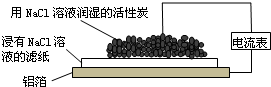
| A. | 铝箔为正极,发生氧化反应而被腐蚀 | |
| B. | 负极反应为2H2O+O2+4e-═4OH- | |
| C. | Cl-由活性炭区向铝箔表面区迁移,铝箔表面有氯气产生 | |
| D. | 白斑的主要成分可能是Al2O3 |
分析 该装置为原电池,铝易失电子发生氧化反应而作负极,碳作正极,发生吸氧腐蚀,电子从负极流向正极,阴离子向负极移动,据此分析.
解答 解:A.铝易失电子发生氧化反应而作负极,碳作正极,故A错误;
B.正极上氧气得电子生成氢氧根离子,则正极的反应为2H2O+O2+4e-═4OH-,故B错误;
C.阴离子向负极移动,Cl-由活性炭区向铝箔表面区迁移,负极上铝失电子,Cl-不失电子,所以没有氯气生成,故C错误;
D.负极上铝离子与氢氧根离子结合生成氢氧化铝,氢氧化铝分解生成Al2O3,则白斑的主要成分可能是Al2O3,故D正确.
故选D.
点评 本题考查金属的腐蚀和原电池原理,侧重于学生的分析能力和应用能力的考查,明确电极上发生的反应是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列化学反应的离子方程式正确的是( )
| A. | 碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+═Ca 2++2H2O+2CO2↑ | |
| B. | 往氨水中滴加氯化铁:Fe 3++3HO-═Fe(OH)3↓+2H2O | |
| C. | 氯化钡溶液与硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | Mg(HCO3)2溶液中加入足NaOH溶液:Mg2++HCO3-+3OH═Mg(OH)2↓+CO32-+H2O |
12.下列实验中,对应的实验现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 在酸性KMnO4溶液中滴加乙醇 | 溶液褪色 | 乙醇发生还原反应 |
| B | 将铜粉加入0.1mol/LFe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C | 将某气体通入品红溶液 | 品红溶液褪色 | 该气体一定是SO2 |
| D | NaHCO3溶液与NaAlO2溶液混合 | 产生白色沉淀 | 酸性HCO3->Al(OH) 3 |
| A. | A | B. | B | C. | C | D. | D |
6.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 25$°\\;C$C、101KPa下,NA个C18O2分子的质量为48g | |
| B. | 标准状况下,22.4L HF中含有的电子数为10NA | |
| C. | 1mol H3+O所含的电子数是11NA | |
| D. | 1L 0.1mol/L的NaClO水溶液中含有的氧原子数为0.1NA |
3.下列化合物中,同分异构体数目超过6个的有( )
| A. | 戊炔 | B. | 已烯 | C. | 1,2-二溴丙烷 | D. | 已烷 |
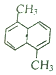 ,其苯环上的二溴代物有9种,苯环上的四溴代物有9种.
,其苯环上的二溴代物有9种,苯环上的四溴代物有9种.



 .
. (或
(或 ).
). 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A为原料合成化合物 的合成路线
的合成路线 .
.