题目内容
1.某饱和一元醇(CnH2n+1OH)14.8g和足量的金属钠反应生成氢气2.24L(标准状况),则3.7g该醇完全燃烧时生成水的质量为( )| A. | 0.9g | B. | 4.5g | C. | 9.0mol | D. | 13.5mol |
分析 某饱和一元醇的通式为CnH2n+1OH,根据关系式:2CnH2n+1OH~H2,求出n,进而求出燃烧3.7g该醇生成水的物质的质量.
解答 解:标准状况下氢气为2.24L即0.1mol,质量为0.2g,
2CnH2n+1OH~H2
(12n+2n+2+16)×2 2
14.8g 0.2g
则$\frac{(12n+2n+2+16)×2}{14.8g}$=$\frac{2}{0.2g}$,所以n=4,
3.7g该醇的物质的量为$\frac{3.7g}{74g/mol}$=0.05mol,根据C4H9OH~5H2O,生成水的物质的质量为0.05mol×5×18g/mol=4.5g;
故选B.
点评 本题主要考查了有机反应的相关计算,掌握饱和一元醇与钠反应生成氢气的关系及其利用氢守恒来计算是解答的关键.

练习册系列答案
相关题目
12.在如图所示的原电池中,下列说法正确的是( )


| A. | 该装置能将电能转化为化学能 | B. | Zn为负极,Cu为正极 | ||
| C. | 电子由Cu电极经 流向Zn电极 流向Zn电极 | D. | 正极反应为 Zn-2e-=Zn2+ |
12.根据元素周期律,下列推断不正确的是( )
| A. | 原子半径:Na>Mg>Al>O>F | B. | 离子半径:O>F>Na>Mg>Al | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:RbOH<KOH<NaOH |
9.下列说法中错误的是( )
| A. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| B. | 碱金属元素中,锂原子失去最外层电子的能力最弱 | |
| C. | 钾与水的反应比钠与水的反应更剧烈 | |
| D. | 因为非金属性Cl>S,盐酸的酸性比氢硫酸强 |
16.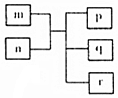 短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
 短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )| A. | 原子半径Y<Z<W | |
| B. | 简单气态氢化物的稳定性Y>Z>W | |
| C. | X与Z形成的化合物的水溶液一定为酸性溶液 | |
| D. | X、Z、W三种元素可以形成离子化合物 |
6.下列物质中,能使FeCl3溶液呈紫色的是( )
| A. | CH3CH2OH | B. |  | C. |  | D. |  |
13.海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示.下列描述错误的是( )


| A. | 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法 | |
| B. | 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品 | |
| C. | 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小 | |
| D. | 用SO2水溶液吸收Br2的离子反应方程式为Br2+SO2+2H2O═4H++SO42-+2Br- |
11.下列物质的性质比较不正确的( )
| A. | 热稳定性:HCl>HBr | B. | 沸点:H2O>H2S | ||
| C. | 碱性:Ca(OH)2>Mg(OH)2 | D. | 酸性:H3PO4>H2SO4 |

