题目内容
9.下列说法中错误的是( )| A. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| B. | 碱金属元素中,锂原子失去最外层电子的能力最弱 | |
| C. | 钾与水的反应比钠与水的反应更剧烈 | |
| D. | 因为非金属性Cl>S,盐酸的酸性比氢硫酸强 |
分析 元素周期表中,同主族元素原子最外层电子数相同,具有相似的化学性质,从上到下,原子半径依次增大,金属性依次增强,非金属性依次减弱,可根据最高价氧化物的酸性、氢化物的稳定性等比较非金属性强弱,以此解答该题.
解答 解:A.同主族元素,从上到下,原子半径依次增大,故A正确;
B.同主族元素,从上到下,金属性依次增强,则锂原子失去最外层电子的能力最弱,故B正确;
C.钾排在钠的下面,金属性强于钠,与水反应比钠更剧烈,故C正确;
D.同周期元素,应根据最高价氧化物的水化物的酸性比较非金属性强弱,故D错误.
故选D.
点评 本题考查了碱金属、卤族元素性质,侧重于学生的分析能力的考查,题目难度不大,掌握同主族元素性质的递变规律是解题的关键.

练习册系列答案
相关题目
20.下列有关原子结构和元素周期律的表述正确的是( )
①短周期元素中正负化合价代数和为4的元素原子为S
②ⅦA族元素是同周期中非金属性最强的元素
③同周期元素原子半径从左到右依次增大
④同主族元素原子从上到下金属性依次减弱,非金属性依次增强.
①短周期元素中正负化合价代数和为4的元素原子为S
②ⅦA族元素是同周期中非金属性最强的元素
③同周期元素原子半径从左到右依次增大
④同主族元素原子从上到下金属性依次减弱,非金属性依次增强.
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
1. 如图,曲线为可逆反应A(g)+2B(g)?2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是( )
如图,曲线为可逆反应A(g)+2B(g)?2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是( )
 如图,曲线为可逆反应A(g)+2B(g)?2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是( )
如图,曲线为可逆反应A(g)+2B(g)?2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是( )| A. | a<b,y轴指B的质量分数 | B. | a>b,y轴指C的质量分数 | ||
| C. | a<b,y轴指A的转化率 | D. | a>b,y轴指A的体积分数 |
17.不符合工业治炼金属情况的是( )
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | 2MgO$\frac{\underline{\;\;△\;\;}}{\;}$2Mg+O2↑ | D. | MgCl2$\frac{\underline{\;电解\;}}{熔融}$Mg+Cl2↑ |
4.关于化学键的下列叙述中,正确的是( )
| A. | 离子化合物可能含共价健 | |
| B. | 离子化合物中一定不含共价键,阳离子只能是金属离子 | |
| C. | 共价化合物可能含离子键 | |
| D. | 有化学键断裂就一定有化学键形成 |
14.下列说法正确的是( )
| A. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的PH减小 | |
| C. | 中和滴定时,滴定管用所盛装的反应液润洗2〜3次 | |
| D. | 室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力增强 |
1.某饱和一元醇(CnH2n+1OH)14.8g和足量的金属钠反应生成氢气2.24L(标准状况),则3.7g该醇完全燃烧时生成水的质量为( )
| A. | 0.9g | B. | 4.5g | C. | 9.0mol | D. | 13.5mol |
19.下列顺序不正确的是( )
| A. | 失电子能力:Na<K | B. | 碱性:NaOH<KOH | ||
| C. | 得电子能力:S<Cl | D. | 酸性:HClO4<H2SO4 |
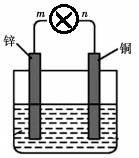 将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2mol•L-1稀硫酸溶液的1.5L容器中构成如图装置.
将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2mol•L-1稀硫酸溶液的1.5L容器中构成如图装置.