题目内容
5.黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一.如图为模拟黄铜矿加工过程的流程图,其中炉渣的主要成分是FeO、Fe2O3、SiO2、Al2O3.请回答下列问题: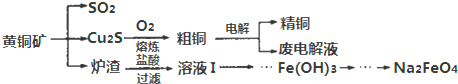
(1)SO2可用于工业制硫酸,传统的硫酸制法反应之一见下列热化学方程式:
SO2(g)+NO2(g)SO3(g)+NO(g);△H<0
①在恒温密闭容器中,按物质的量之比为2:1投入SO2和NO2,一定温度下反应达平衡,此时SO2和NO2的物质的量之比变为4:1,则该温度下反应的平衡常数K=1.
②若其他初始条件相同,将恒温容器改为绝热容器,则达平衡时SO2的转化率与恒温容器中的相比将变小(填“变大”、“变小”或“不变”).
(2)Cu2S熔炼制取粗铜的反应如下:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g);△H=-768.2kJ•mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g);△H=+116.0kJ•mol-1
则总反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g) 的△H=-217.4kJ/mol.
(3)已知:Ksp(PbS)=9.0×10-29,Ksp(ZnS)=2.925×10-25.粗铜电解精炼废电解液中常含有Pb2+、Zn2+,向其中加入Na2S溶液,当有PbS和ZnS沉淀共存时,c(Zn2+):c(Pb2+)=3250.
(4)溶液Ⅰ中Fe元素存在形式是Fe2+、Fe3+.从溶液Ⅰ→…→Fe(OH)3的实验操作依次是:
氧化、调pH、过滤、洗涤…;检验Fe(OH)3是否洗净的方法是取最后一次洗涤液,加入硝酸酸化,再加入硝酸银溶液,若无沉淀产生,证明已洗净.
(5)Na2FeO4和Zn可以组成碱性电池,其反应的离子方程式为:
3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-
请写出放电时正极的电极反应式2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-.
分析 (1)①根据反应NO2(g)+SO2(g)?SO3(g)+NO(g),利用三段式求出平衡时的浓度,然后计算平衡常数;
②该反应为放热反应,在绝热容器中,温度升高,结合温度对平衡的影响分析;
(2)利用盖斯定律把分方程改写在相加减得到目标方程式;
(3)(4)根据c(Zn2+):c(Pb2+)=$\frac{Ksp(Zns)}{Ksp(Pbs)}$计算;
(4)炉渣的主要成分是FeO、Fe2O3、SiO2、Al2O3,加盐酸溶解溶液中含有Fe2+、Fe3+等;溶液中含有大量的氯离子,若沉淀没有洗涤干净,则洗液中会含有氯离子,用硝酸银和稀硝酸检验;
(5)依据原电池反应,3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-,正极上FeO42-发生还原反应.
解答 解:(1)①在恒温密闭容器中,按物质的量之比为2:1投入SO2和NO2,设SO2为2mol,NO2为1mol
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始物质的量(mol) 2 1 0 0
转化物质的量(mol) x x x x
平衡物质的量(mol) 2-x 1-x x x
一定温度下反应达平衡,此时SO2和NO2的物质的量之比变为4:1,则(2-x):(1-x)=4:1,故x=$\frac{2}{3}$,
故平衡常数为=$\frac{\frac{\frac{2}{3}}{V}×\frac{\frac{2}{3}}{V}}{\frac{\frac{4}{3}}{V}×\frac{\frac{1}{3}}{V}}$=1;
故答案为:1;
②该反应为放热反应,在绝热容器中,温度升高,反应逆向进行,转化率减小,所以将恒温容器改为绝热容器,则达平衡时SO2的转化率与恒温容器中的相比将变小;
故答案为:变小;
(2)2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g);△H=-768.2kJ•mol-1①
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g);△H=+116.0kJ•mol-1②;
由盖斯定律可知:①×$\frac{1}{3}$+②×$\frac{1}{3}$得到Cu2S(s)+O2(g)=2Cu(s)+SO2(g),则其△H=-217.4kJ/mol;
故答案为:-217.4kJ/mol;
(3)C(Zn2+):C(Pb2+)=$\frac{Ksp(Zns)}{Ksp(Pbs)}$=$\frac{9.0×1{0}^{-29}}{2.925×1{0}^{-25}}$=3250;
故答案为:3250;
(4)炉渣的主要成分是FeO、Fe2O3、SiO2、Al2O3,加盐酸溶解溶液中含有Fe2+、Fe3+等,所以溶液Ⅰ中Fe元素存在形式是Fe2+、Fe3+;溶液中含有大量的氯离子,若沉淀没有洗涤干净,则沉淀表面会附着有氯离子,则洗液中也会含有氯离子,用硝酸银和稀硝酸检验,所以检验Fe(OH)3是否洗净的方法是取最后一次洗涤液,加入硝酸酸化,再加入硝酸银溶液,若无沉淀产生,证明已洗净;
故答案为:Fe2+、Fe3+;取最后一次洗涤液,加入硝酸酸化,再加入硝酸银溶液,若无沉淀产生,证明已洗净;
(5)反应原理为:3Zn+2FeO42-+8H20═3Zn(OH)2+2Fe(0H)3+40H-,正极电极反应式为:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-,
故答案为:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-.
点评 本题考查学生阅读题目获取信息的能力、盖斯定律的应用、氧化还原反应、原电池的工作原理的应用,电极反应,电极产物的判断等,题目难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力.注意基础知识的全面掌握.

| A. | 铁有剩余 | |
| B. | 往反应后溶液中滴入KSCN溶液,显红色 | |
| C. | 溶液变为浅绿色 | |
| D. | Fe2+和Fe3+物质的量之比为6:1 |
| A. | 2.3gNa变成Na+时,失去的电子数为0.2NA | |
| B. | 0.2NA个H2SO4与19.6gH3PO4含有相同的氧原子数 | |
| C. | 28gN2所含原子数为NA | |
| D. | NA个O2与NA个H2的质量比为8:1 |
| A. | 一定温度下,将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变,$\frac{c({F}^{-})}{c(HF)}$始终保持增大 | |
| B. | 浓度均为0.1mol•L-1的Na2SO3、NaHSO3混合溶液中:3c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | 在0.1mol•L-1氨水中滴加0.1mol•L-1盐酸,恰好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol•L-1 | |
| D. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4的溶解度小于AgCl |
| A. | 油炸薯条 | B. | 碳酸饮料 | C. | 烤羊肉串 | D. | 新鲜蔬菜 |
| A. | 石油和天然气的主要成分都是碳氢化合物 | |
| B. | 己烯、苯都能与溴的四氯化碳溶液因发生化学反应而使其褪色 | |
| C. | 乙烯、氯乙烯、苯乙烯都可以合成有机高分子材料 | |
| D. | 苯酚、乙醇、乙醛都能被酸性KMnO4溶液氧化而使KMnO4溶液褪色 |
| A. | 3.2g的Cu与足量的浓HNO3反应生成的气体分子数为NA | |
| B. | pH=2的硫酸氢钠溶液中的硫酸根离子数为0.01NA | |
| C. | 8g CH4中含有的共价键总数为NA | |
| D. | 含有NA个中子的D2O的质量为2.0g |
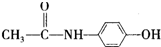 ,从下简称F)是最常用的非甾体消炎解热镇痛药,用于治疗感冒发烧、关节痛、神经痛、偏头痛等,它可用最简单的烯烃A等合成:
,从下简称F)是最常用的非甾体消炎解热镇痛药,用于治疗感冒发烧、关节痛、神经痛、偏头痛等,它可用最简单的烯烃A等合成: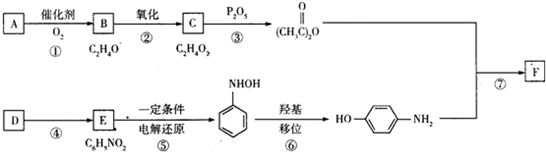
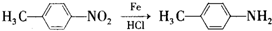
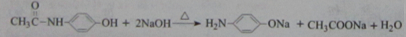 .
.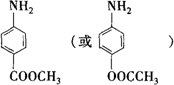 .
.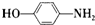 的合成路线
的合成路线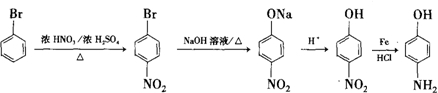 .
.