题目内容
15.将1.12g铁粉加入25mL2mol/L的FeCl3溶液中,充分反应后,其结果是( )| A. | 铁有剩余 | |
| B. | 往反应后溶液中滴入KSCN溶液,显红色 | |
| C. | 溶液变为浅绿色 | |
| D. | Fe2+和Fe3+物质的量之比为6:1 |
分析 1.12g铁物质的量n(Fe)=$\frac{1.12g}{56g/mol}$=0.02mol,25mL 2mol/L氯化铁溶液中n(Fe3+)=0.025L×2mol/L=0.05mol,发生的离子反应为Fe+2Fe3+═3Fe2+,结合反应及离子的检验来解答.
解答 解:1.12g铁物质的量n(Fe)=$\frac{1.12g}{56g/mol}$=0.02mol,25mL 2mol/L氯化铁溶液中n(Fe3+)=0.025L×2mol/L=0.05mol;
发生的反应为:Fe+2Fe3+═3Fe2+;
0.02mol 0.04mol 0.06mol
由上述反应可知:三价铁离子剩余0.01mol,溶液中含有Fe3+物质的量为0.01mol,Fe2+物质的量为0.06mol,无金属铁剩余;
A、铁无剩余,故A错误;
B、溶液中有剩余的三价铁离子,往溶液中滴入无色KSCN溶液,显红色,故B正确;
C、溶液中含有Fe3+物质的量为0.01mol,Fe2+物质的量为0.06mol,颜色不是浅绿色,故C错误;
D、Fe2+和Fe3+的物质的量之比为6:1,故D正确;
故选BD.
点评 本题考查氧化还原反应计算及铁的性质,为高频考点,把握发生的反应及物质的量关系等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
10.现将等物质的量的CuSO4、FeCl3、Zn放入盛有水的烧杯中充分反应,所得溶液中除SO42-、Cl-外,还含有的金属阳离子是( )
| A. | Zn2+、Cu2+、Fe3+ | B. | Zn2+、Cu2+、Fe2+ | ||
| C. | Zn2+、Fe2+、Cu2+、Fe3+ | D. | Zn2+、Fe3+ |
20.下列各式中,属于正确的水解方程式的是( )
| A. | Fe3++3H2O?Fe(OH)3↓+3H+ | B. | NH4++2H2O?NH3•H2O+H3O+ | ||
| C. | CH3COOH+H2O?CH3COO-+H3O+ | D. | Br-+H2O?HBr+OH- |



 .
. 同分异构体有4种.
同分异构体有4种. 的合成路线(用流程图表示,无机试剂任选)注:合成路线的书写格式参照如下实例:
的合成路线(用流程图表示,无机试剂任选)注:合成路线的书写格式参照如下实例: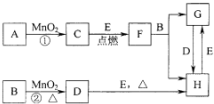 图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.
图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.
 ;④CH4与C3H8;⑤CH3CH2CH2CH3与
;④CH4与C3H8;⑤CH3CH2CH2CH3与  .请回答下列问题:
.请回答下列问题: 的名称是2-甲基丙烷.
的名称是2-甲基丙烷.