题目内容
19.下列说法正确的是 ( )| A. | 一定温度下,将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变,$\frac{c({F}^{-})}{c(HF)}$始终保持增大 | |
| B. | 浓度均为0.1mol•L-1的Na2SO3、NaHSO3混合溶液中:3c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | 在0.1mol•L-1氨水中滴加0.1mol•L-1盐酸,恰好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol•L-1 | |
| D. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4的溶解度小于AgCl |
分析 A、弱酸加水稀释,其电离度增大,电离平衡常数不变,氟离子和氢离子物质的量同等程度的增大;
B、根据溶液中的物料守恒知识来回答;
C、完全中和生成氯化铵,为强酸弱碱盐,水解呈酸性;
D、根据溶度积可计算溶液的物质的量浓度,根据物质的量浓度可比较.
解答 解:A、将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,Ka(HF)=c(H+)×$\frac{c({F}^{-})}{c(HF)}$始终保持增大保持不变,氢离子浓度减小,$\frac{c({F}^{-})}{c(HF)}$始终保持增大,电离度增加,故A错误;
B、浓度均为0.1mol•L-1的Na2SO3、NaHSO3混合溶液中,存在:2c(Na+)=3[c(SO32-)+c(HSO3-)+c(H2SO3),故B错误;
C、在0.1mol•L-1氨水中滴加0.1mol•L-1盐酸,刚好完全中和时,得到氯化铵溶液pH=a,此时a<7,水的电离受到促进,则溶液中水电离产生的c(OH-)=10-amol•L-1,故C正确;
D、Ksp(Ag2CrO4)=x2×0.5x=0.5x3=2.0×10-12,x3=4.0×10-12,即x═$\root{3}{4×1{0}^{-12}}$,因为AgCl饱和溶液中Ag+的浓度为$\sqrt{1.8×1{0}^{-10}}$,所以溶解度Ag2CrO4>AgCl,故D错误.
故选C.
点评 本题考查了溶液pH的计算、溶液中离子浓度大小比较、难溶电解质的沉淀平衡等知识,题目难度中等,注意掌握酸碱混合后溶液的定性判断及溶液中pH的计算方法,学会利用电荷守恒、物料守恒、盐的水解原理结合溶液中的电离平衡问题.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
9.下列反应属于吸热反应的是( )
| A. | 锌粒与稀硫酸的反应 | |
| B. | 生石灰与水的反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
10.现将等物质的量的CuSO4、FeCl3、Zn放入盛有水的烧杯中充分反应,所得溶液中除SO42-、Cl-外,还含有的金属阳离子是( )
| A. | Zn2+、Cu2+、Fe3+ | B. | Zn2+、Cu2+、Fe2+ | ||
| C. | Zn2+、Fe2+、Cu2+、Fe3+ | D. | Zn2+、Fe3+ |
14.Cu2O和CuO组成的混合物中,Cu的质量分数为88%,则混合物中含Cu2O和CuO的物质的量之比( )
| A. | 5:1 | B. | 4:1 | C. | 3:2 | D. | 1:5 |
9.有下列八种物质:①氯化钙、②金刚石、③硫、④氢氧化钠、⑤二氧化硅、⑥干冰,回答有关这八种物质的问题.(用编号回答)
(1)将这八种物质按不同晶体类型分成四组,并填写下表:
(2)属于共价化合物的是⑤⑥;含有共价键的离子化合物是④;
(3)其中硬度最大的物质是②;熔点最低的物质是⑥.
(1)将这八种物质按不同晶体类型分成四组,并填写下表:
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 |
| 各组中物质的编号 | ①④ | ②⑤ | ③⑥ |
(3)其中硬度最大的物质是②;熔点最低的物质是⑥.
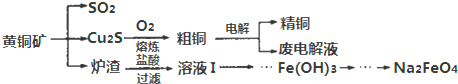

 .
. .
. 与过量的
与过量的 也可以发生Reformatsky反应,试写出该生成物的结构简式
也可以发生Reformatsky反应,试写出该生成物的结构简式 .
.