题目内容
20.在25℃时,下列各种情况下一定能大量共存的离子组为( )| A. | pH=7的溶液中:Fe3+、Cl-、Na+、NO3- | |
| B. | 由水电离出的c(H+)=1×10-13 mol•L-1的水溶液中Na+、CO32-、Cl-、K+ | |
| C. | 无色透明的酸性溶液中NH4+、NO3-、Al3+、Cl- | |
| D. | Al3+、HCO3-、I-、Ca2+ |
分析 A.Fe3+在pH为4.4左右沉淀完全;
B.由水电离出的c(H+)=1×10-13 mol•L-1的水溶液,为酸或碱溶液;
C.酸性溶液中该组离子之间不反应;
D.离子之间相互促进水解.
解答 解:A.Fe3+在pH为4.4左右沉淀完全,则pH=7的溶液中不能大量存在Fe3+,故A不选;
B.由水电离出的c(H+)=1×10-13 mol•L-1的水溶液,为酸或碱溶液,酸溶液中不能大量存在CO32-,故B不选;
C.酸性溶液中该组离子之间不反应,可大量共存,故C选;
D.Al3+、HCO3-相互促进水解,不能共存,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、水解反应的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.浓硫酸的危险警告标签是( )
| A. |  | B. |  | C. |  | D. |  |
11.下列说法不正确的是( )
| A. | Na与乙醇反应时的反应速率比与水反应时的慢 | |
| B. | 除去乙烷中混有的少量乙烯的方法可以是将其通入溴的四氯化碳溶液中 | |
| C. | 已知 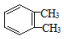 和 和 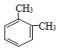 是同一种物质,说明苯分子中的碳碳键不是单双键交替的 是同一种物质,说明苯分子中的碳碳键不是单双键交替的 | |
| D. | .苯不能使酸性高猛酸钾溶液褪色,所以苯不能发生氧化反应 |
8.下列有关硅及其化合物的说法正确的是( )
| A. | 硅酸钠属于盐不属于碱,所以硅酸钠可保存在磨口塞得试剂瓶中 | |
| B. | 反应 Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$ Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强 | |
| C. | 普通玻璃,石英玻璃,水泥等均属于硅酸盐材料 | |
| D. | 祖母绿的主要成分是 Be3Al2Si6O18,用氧化物的形式表示为 3BeO•Al2O3•6SiO2 |
15. 常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
 常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )| A. | 常温下,电离平衡常数Ka(HR)≈Kb(NH3•H2O) | |
| B. | b点溶液pH=7,此时HR溶液与氨水恰好完全反应 | |
| C. | c点溶液中存在c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a、b、c三点中,c点NH3•H2O的电离程度最大 |
5.某有机化合物D的结构为  ,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中不正确的是( )
,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中不正确的是( )
 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中不正确的是( )
,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中不正确的是( )| A. | 烃A为乙烯 | |
| B. | 反应①、②、③的反应类型依次为加成反应,取代反应,取代反应 | |
| C. | 反应③为了加快反应速率可以快速升温至170℃度 | |
| D. | 化合物D属于醚 |
12.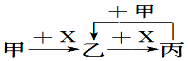 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )
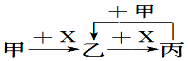 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X(要求甲和X能互换)不可能是( )| A. | C和O2 | B. | CO2和NaOH溶液 | ||
| C. | Cl2和Fe | D. | AlCl3溶液和NaOH溶液 |
9.下列有关化学反应速率的说法中,正确的是( )
| A. | 实验事制氢气时,加入少量NaNO3固体,不影响反应速率 | |
| B. | 锌片分别与等pH的醋酸、硫酸反应,平均反应速率相等 | |
| C. | 升高温度后,吸热反应的速率加快,放热反应的速率减慢 | |
| D. | 纳米铁粉在空气中自燃,是因为纳米铁粉的表面积大 |
10.将表面有氧化膜的铝片伸入足量的NaOH溶液中,有关离子方程式正确的是( )
| A. | Al2O3+OH-→AlO2-+H2O | B. | 2Al3++6OH-→2Al(OH)3↓ | ||
| C. | 2Al+2OH-+2H2O→2AlO2-+3H2↑ | D. | 2Al+6H2O→2Al3++6OH-+3H2↑ |