题目内容
10.我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾.检验食盐 中是否加碘,可利用如下反应:1KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(1)将上面氧化还原反应的化学方程式配平.
(2)该反应中氧化剂和还原剂的物质的量之比为1:5.
(3)如果反应中转移 0.5mol 电子,则生成 I2的物质的量为0.3mol.
(4)若要提取生成的碘,所用的萃取剂可以是④(填序号).
①水 ②酒精 ③淀粉溶液 ④苯.
分析 反应物KIO3中I元素化合价为+5价,KI中I元素化合价为-1价,反应中I元素化合价分别由+5价、-1价变化为0价,KIO3为氧化剂,KI为还原剂,结合元素化合价的变化解答该题.
解答 解:(1)反应物KIO3中I元素化合价为+5价,KI中I元素化合价为-1价,反应中I元素化合价分别由+5价、-1价变化为0价,可知(KIO3):n(KI)=1:5,结合质量生成配平方程式为KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,
故答案为:1;5;3;3;3;3;
(2)KIO3为氧化剂,KI为还原剂,由方程式可知氧化剂和还原剂的物质的量之比为1:5,
故答案为:1:5;
(3)在上述反应中,转移5mol电子生成碘单质的量是3mol,所以如果反应中转移0.5mol电子,则生成I2的物质的量为0.3moL,
故答案为:0.3mol;
(4)碘在有机溶液中的溶解度远大于在水中的溶解度,所以采用萃取的方法提取碘,可以选用四氯化碳作萃取,
故答案为:④.
点评 本题考查学生氧化还原反应,侧重于学生的分析能力和计算能力的考查,注意把握电子转移和化合价变化之间的关系、化学反应规律等知识,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
相关题目
20.食用酱油中的“氯丙醇”是多种氯代丙醇的总称.其中,二氯丙醇(不含主 结构)共有( )
结构)共有( )
 结构)共有( )
结构)共有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
1.已知25℃时有关弱酸的电离平衡常数:
根据上述已知数据,回答下列问题:
(1)三种酸(CH3COOH、HCN、H2CO3)的酸性由强到弱的顺序是CH3COOH>H2CO3>HCN
(2)等物质的量的三种算的正盐(CH3COONa、NaCN、Na2CO3),其pH由大到小的顺序是Na2CO3溶液>NaCN溶液>CH3COONa溶液.
(3)常温下,体积为10ml pH=2的CH3COOH溶液与HCN溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者>后者(填“>”、“<”或“=”).
(4)用电离方程式表示NaCN溶液显碱性的原因CN-+H2O?HCN+OH-,其溶液中离子浓度由大到小的关系是c(Na+)>c(CN-)>c(OH-)>c(H+).
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
(1)三种酸(CH3COOH、HCN、H2CO3)的酸性由强到弱的顺序是CH3COOH>H2CO3>HCN
(2)等物质的量的三种算的正盐(CH3COONa、NaCN、Na2CO3),其pH由大到小的顺序是Na2CO3溶液>NaCN溶液>CH3COONa溶液.
(3)常温下,体积为10ml pH=2的CH3COOH溶液与HCN溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者>后者(填“>”、“<”或“=”).
(4)用电离方程式表示NaCN溶液显碱性的原因CN-+H2O?HCN+OH-,其溶液中离子浓度由大到小的关系是c(Na+)>c(CN-)>c(OH-)>c(H+).
18.下列说法正确的是( )
| A. | 石油裂化、石油分馏、煤的气化、石油中提取石蜡都是化学变化 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 实验事实证明乙酸乙酯中少量乙醇可以用水洗方法除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| D. | 除去甲烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 |
5.下列解释事实的方程式正确的是( )
| A. | 在空气中切开金属钠,光亮表面变暗:2Na+O2═Na2O2 | |
| B. | 向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3++3OH-═Al(OH)3 | |
| C. | 将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2↑ | |
| D. | Al2O3 粉末溶于 NaOH 溶液中:Al2O3+2OH-═2AlO2-+H2O |
15. 常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
 常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )| A. | 常温下,电离平衡常数Ka(HR)≈Kb(NH3•H2O) | |
| B. | b点溶液pH=7,此时HR溶液与氨水恰好完全反应 | |
| C. | c点溶液中存在c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a、b、c三点中,c点NH3•H2O的电离程度最大 |
2.下列关于结构式的叙述中正确的是( )
| A. | 表示组成分子中的各原子在空间的位置 | |
| B. | 以共价键相连的两原子间总以一条短线相连 | |
| C. | 结构式和球棍模型在表示分子结构上作用相同 | |
| D. | 用一条短线表示一对共用电子对的图式反映共价分子中各原子的连接顺序 |
19.化学与生活密切相关.下列有关说法错误的是( )
| A. | 大量排放含氮、磷的生活污水可使水体富营养化 | |
| B. | “曾青得铁,则化为铜”是描述金属间的置换反应 | |
| C. | 光化学姻雾的形成主要与硫氧化物的排放有关 | |
| D. | 硅是光伏太阳能电池的光电半导体材料 |
20.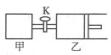 如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )
如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )
 如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )
如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )| A. | 甲中反应的平衡常数小于乙 | |
| B. | 当乙中A与B的体积分数之比为1:2时,反应达到平衡状态 | |
| C. | 平衡时甲容器中A的物质的量小于0.55 mol | |
| D. | 若打开活塞K,达平衡时乙容器的体积为3.2 L |