题目内容
5.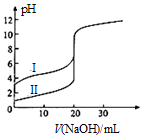 25℃时,用0.1000mol•L-1NaOH溶液分别滴定20.00ml 0.1000mol•L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
25℃时,用0.1000mol•L-1NaOH溶液分别滴定20.00ml 0.1000mol•L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等 | |
| C. | V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | V(NaOH)=20.00mL时,两溶液中 c(CH3COO-)>c(Cl-) |
分析 A.盐酸为强酸,醋酸为弱酸,浓度相同时盐酸的pH较小;
B.浓度、体积相等时,醋酸与氢氧化钠反应生成醋酸钠溶液呈碱性,而盐酸与氢氧化钠反应生成氯化钠,溶液呈中性;
C.V(NaOH)=10.00mL时,反应后溶质为等浓度的醋酸和醋酸钠,醋酸的电离程度较大,溶液呈酸性;
D.V(NaOH)=20.00mL时,反应后溶质为醋酸钠和氯化钠,醋酸根离子部分水解,则醋酸根离子浓度较小.
解答 解:A.根据图示可知,Ⅰ的pH较大,Ⅱ的pH较小,则Ⅰ表示的是醋酸,Ⅱ表示盐酸,故A错误;
B.醋酸为弱酸,溶液体积相同时,醋酸和氯化氢的物质的量相等,醋酸与氢氧化钠反应生成醋酸钠,溶液呈碱性,若pH=7时,醋酸的体积应该稍大,故B错误;
C.V(NaOH)=10.00mL时,反应后溶质浓度相同的醋酸和醋酸钠,醋酸的电离程度较大,溶液呈酸性,则c(H+)>c(OH-),反应后溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D.V(NaOH)=20.00mL时,两溶液都恰好反应,由于醋酸根离子部分水解,则两溶液中 c(CH3COO-)<c(Cl-),故D错误;
故选C.
点评 本题考查了酸碱混合的定性判断,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
16.下列反应中,水作还原剂的反应是( )
| A. | CaO+H2O→Ca(OH)2 | B. | 2Na+2H2O→2NaOH+H2↑ | ||
| C. | 2F2+2H2O→4HF+O2 | D. | 2H2+O2$\stackrel{点燃}{→}$2H2O |
17.同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶气体一定具有相同的( )
| A. | 质量 | B. | 密度 | C. | 碳原子数 | D. | 原子总数 |
13.下列烃在光照下与氯气反应,只生成一种一氯代物的有( )
| A. | 2-甲基丙烷 | B. | 异戊烷 | C. | 乙苯 | D. | 2,2-二甲基丙烷 |
20.食用酱油中的“氯丙醇”是多种氯代丙醇的总称.其中,二氯丙醇(不含主 结构)共有( )
结构)共有( )
 结构)共有( )
结构)共有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
10.浓硫酸的危险警告标签是( )
| A. |  | B. |  | C. |  | D. |  |
17.工业制备下列物质的反应方程式不正确的是( )
| A. | 工业制漂白粉:Cl2+2NaOH═NaCl+NaClO+H2O | |
| B. | 工业制粗硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO | |
| C. | 工业合成氨:N2+3H2 $?_{催化剂}^{高温高压}$ 2NH3 | |
| D. | 工业炼铁:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
15. 常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
 常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )| A. | 常温下,电离平衡常数Ka(HR)≈Kb(NH3•H2O) | |
| B. | b点溶液pH=7,此时HR溶液与氨水恰好完全反应 | |
| C. | c点溶液中存在c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a、b、c三点中,c点NH3•H2O的电离程度最大 |
 (1)对于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp=c(Ag+)2•c(S2-)(写表达式).
(1)对于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp=c(Ag+)2•c(S2-)(写表达式).