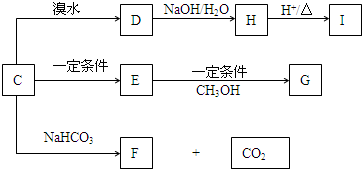
题目内容
周期表中有些元素有“对角线相似”现象,如Li、Mg;Be、Al;B、Si等两两性质相似.若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体.下列说法正确的是( )
| A、LiOH易溶于水 |
| B、电解前LiCl在加热时已发生水解 |
| C、无色气体为电解生成的H2 |
| D、Li和水反应要比Na和水剧烈 |
考点:元素周期律和元素周期表的综合应用,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、LiOH与氢氧化镁性质相似;
B、LiCl与氯化镁性质相似;
C、已潮解的LiCl加热蒸干并强热,可得氧化锂,电解会产生氧气;
D、Li的金属性弱于Na,所以活泼性弱于钠,据此判断.
B、LiCl与氯化镁性质相似;
C、已潮解的LiCl加热蒸干并强热,可得氧化锂,电解会产生氧气;
D、Li的金属性弱于Na,所以活泼性弱于钠,据此判断.
解答:
解:A、LiOH与氢氧化镁性质相似,都是难溶于水,故A错误;
B、LiCl与氯化镁性质相似,氯化镁受热易水解,生成氢氧化镁,再高温,可得氧化镁,故B正确;
C、已潮解的LiCl加热蒸干并强热,可得氧化锂,电解会产生氧气,故C错误;
D、Li的金属性弱于Na,所以活泼性弱于钠,所以与水反应的剧烈程度小于钠,故D错误;
故选B.
B、LiCl与氯化镁性质相似,氯化镁受热易水解,生成氢氧化镁,再高温,可得氧化镁,故B正确;
C、已潮解的LiCl加热蒸干并强热,可得氧化锂,电解会产生氧气,故C错误;
D、Li的金属性弱于Na,所以活泼性弱于钠,所以与水反应的剧烈程度小于钠,故D错误;
故选B.
点评:本题主要考查了对角线规则的应用,难度不大,解题时注意充分利用锂和镁的性质的相似性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4下列关于该反应的说法正确的是( )
| A、CuSO4发生了氧化反应 |
| B、生成1 mol H3PO4时,有10 mol 电子转移 |
| C、白磷只作还原剂 |
| D、氧化产物和还原产物的物质的量之比为6:5 |
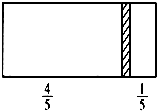 在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分.当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同).则混合气体中CO和CO2的分子个数比为( )
在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分.当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同).则混合气体中CO和CO2的分子个数比为( )| A、1:1 | B、1:3 |
| C、2:1 | D、3:1 |
X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大.下列说法正确的是( )
| A、M与X形成的化合物对应的水化物一定是强酸 |
| B、Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 |
| C、X、Y的简单离子半径:r(X2-)>r(Y+) |
| D、M的气态氢化物比N的气态氢化物稳定 |
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B、欲配置1.00L,1.00mol?L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
| C、标准状况下,11.2L CH3CH2OH中含有分子的数目为0.5NA |
| D、常温常压下,8g氧气含有4NA个电子 |