题目内容
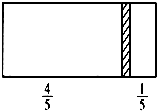 在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分.当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同).则混合气体中CO和CO2的分子个数比为( )
在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分.当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同).则混合气体中CO和CO2的分子个数比为( )| A、1:1 | B、1:3 |
| C、2:1 | D、3:1 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:同温同压下,气体摩尔体积相等,气体的体积之比等于其物质的量之比,所以CO和CO2的物质的量是氮气的
,为0.25mol,设CO的物质的量由混合气体质量计算二者的物质的量,再根据N=nNA计算二者的分子个数之比.
| 1 |
| 4 |
解答:
解:同温同压下,气体摩尔体积相等,气体的体积之比等于其物质的量之比,所以CO和CO2的物质的量是氮气的
,为0.25mol,设CO的物质的量是xmol,则二氧化碳的物质的量为(0.25mol-xmol),根据二者的质量得28xg+44g/mol×(0.25-x)mol=8g,x=
,则二氧化碳的物质的量=(
-
)mol=
mol,
根据N=nNA知,二者的分子个数之比等于物质的量之比=
mol:
mol=3:1,故选D.
| 1 |
| 4 |
| 3 |
| 16 |
| 1 |
| 4 |
| 3 |
| 16 |
| 1 |
| 16 |
根据N=nNA知,二者的分子个数之比等于物质的量之比=
| 3 |
| 16 |
| 1 |
| 16 |
点评:本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,熟练掌握物质的量有关公式,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某结晶水合物的化学式为R?nH2O,其式量为M.25℃时,将ag该晶体溶于bg水中可形成VmL饱和溶液.下列关系中正确的是( )
A、饱和溶液的物质的量浓度为c=
| ||
B、25℃时R的溶解度为S=
| ||
C、饱和溶液中溶质的质量分数为W=
| ||
D、饱和溶液的密度为ρ=
|
鲜榨苹果汁中含有Fe2+,在空气中,Fe2+(淡绿色)会转化为Fe3+(棕黄色).若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有( )
| A、氧化性 | B、还原性 |
| C、酸性 | D、碱性 |
下列与胶体有关的实验描述正确的是( )
| A、用一束激光照射胶体和溶液都有光亮的通路 |
| B、制备氢氧化铁胶体时加入的饱和氯化铁溶液越多越好 |
| C、用过滤的方法不能分离氢氧化铁胶体和氯化铁溶液 |
| D、向氢氧化铁胶体中加入过量盐酸后出现红褐色沉淀 |
在标准状况下,0.5molH2的体积是( )
| A、0.5 L |
| B、2.0 L |
| C、11.2 L |
| D、22.4 L |
周期表中有些元素有“对角线相似”现象,如Li、Mg;Be、Al;B、Si等两两性质相似.若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体.下列说法正确的是( )
| A、LiOH易溶于水 |
| B、电解前LiCl在加热时已发生水解 |
| C、无色气体为电解生成的H2 |
| D、Li和水反应要比Na和水剧烈 |
下列离子方程式中,正确的是( )
| A、稀硫酸滴在铁片上:2Fe+6H+=Fe3++3H2↑ |
| B、过量的CO2通入澄清的石灰水中:CO2+OH-=HCO3- |
| C、碳酸钙溶于足量的盐酸中:CO32-+2H+=H2O+CO2↑ |
| D、过量的NaHCO3溶液与Ca(OH)2溶液混合:Ca2++HCO3-+OH-=CaCO3↓+H2O |