题目内容
某天然碱的组成为xNa2CO3?yNaHCO3?zH2O将称取的4.56g样品于300℃加热分解至完全(300℃时Na2CO3不分解),得到残留固体3.71g,分解产生的气体通入足量饱和的澄清石灰水中,全部吸收后可得到0.500g沉淀.请计算:
(1)该样品中结晶水的质量分数;
(2)通过计算确定该天然碱的化学式.
(1)该样品中结晶水的质量分数;
(2)通过计算确定该天然碱的化学式.
考点:化学方程式的有关计算
专题:
分析:(1)固体减轻质量=NaHCO3分解生成水和二氧化碳的质量+样品中H2O的质量,根据生成碳酸钙的质量计算出二氧化碳的物质的量,然后根据碳酸氢钠的分解反应计算出碳酸氢钠分解生成水的质量,从而计算出样品中结晶水的质量,再计算出结晶水在样品中的质量分数;
(2)3.71g为碳酸氢钠分解生成的碳酸钠和该碱中原来含有的碳酸钠,根据二氧化碳的物质的量计算出碳酸氢钠分解生成的碳酸钠的物质的量,从而得出原碱中含有的碳酸钠的物质的量,根据三者物质的量比计算出x:y:z的比,即可得出该样品的化学式.
(2)3.71g为碳酸氢钠分解生成的碳酸钠和该碱中原来含有的碳酸钠,根据二氧化碳的物质的量计算出碳酸氢钠分解生成的碳酸钠的物质的量,从而得出原碱中含有的碳酸钠的物质的量,根据三者物质的量比计算出x:y:z的比,即可得出该样品的化学式.
解答:
解:0.500g沉淀为碳酸钙沉淀,根据C原子守恒生成二氧化碳气体的物质的量为:n(CO2)=n(CaCO3)=
=0.005mol,
即:4.56g样品分解产生的二氧化碳物质的量为0.005mol,
根据反应2NaHCO3
Na2CO3+H2O+CO2↑可知,
2mol 1mol 1mol
0.01mol 0.005mol 0.005mol
4.56g样品中含有碳酸氢钠的物质的量为0.01mol,碳酸氢钠分解生成水、碳酸钠的物质的量都为0.005mol,
4.56g样品于300℃加热分解至完全(300℃时Na2CO3不分解),得到残留固体3.71g,固体减少的质量为二氧化碳和水的质量,则样品中含有结晶水的质量为:4.56g-3.71g-18g/mol×0.005mol-44g/mol×0.005mol=0.54g,结晶水的物质的量为:
=0.03mol,
(1)样品中结晶水的质量分数为:
×100%=11.8%,
答:该样品中结晶水的质量分数为11.8%;
(2)3.71g为碳酸钠,碳酸钠的物质的量为:
=0.035mol,
则样品中NaHCO3分解生成0.005mol碳酸钠,则样品中碳酸钠的物质的量为:0.035mol-0.005mol=0.03mol,
所以:x:y:z=0.03mol:0.01:0.03mol=3:1:3,
则该天然碱的化学式为:3Na2CO3?NaHCO3?3H2O,
答:该天然碱的化学式为3Na2CO3?NaHCO3?3H2O.
| 0.500g |
| 100g/mol |
即:4.56g样品分解产生的二氧化碳物质的量为0.005mol,
根据反应2NaHCO3
| ||
2mol 1mol 1mol
0.01mol 0.005mol 0.005mol
4.56g样品中含有碳酸氢钠的物质的量为0.01mol,碳酸氢钠分解生成水、碳酸钠的物质的量都为0.005mol,
4.56g样品于300℃加热分解至完全(300℃时Na2CO3不分解),得到残留固体3.71g,固体减少的质量为二氧化碳和水的质量,则样品中含有结晶水的质量为:4.56g-3.71g-18g/mol×0.005mol-44g/mol×0.005mol=0.54g,结晶水的物质的量为:
| 0.54g |
| 18g/mol |
(1)样品中结晶水的质量分数为:
| 0.54g |
| 4.56g |
答:该样品中结晶水的质量分数为11.8%;
(2)3.71g为碳酸钠,碳酸钠的物质的量为:
| 3.71g |
| 106g/mol |
则样品中NaHCO3分解生成0.005mol碳酸钠,则样品中碳酸钠的物质的量为:0.035mol-0.005mol=0.03mol,
所以:x:y:z=0.03mol:0.01:0.03mol=3:1:3,
则该天然碱的化学式为:3Na2CO3?NaHCO3?3H2O,
答:该天然碱的化学式为3Na2CO3?NaHCO3?3H2O.
点评:本题考查了有关化学方程式的计算,题目难度中等,明确加热前后固体质量变化为解答关键,注意掌握有关化学方程式计算的方法,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
鲜榨苹果汁中含有Fe2+,在空气中,Fe2+(淡绿色)会转化为Fe3+(棕黄色).若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有( )
| A、氧化性 | B、还原性 |
| C、酸性 | D、碱性 |
在标准状况下,0.5molH2的体积是( )
| A、0.5 L |
| B、2.0 L |
| C、11.2 L |
| D、22.4 L |
周期表中有些元素有“对角线相似”现象,如Li、Mg;Be、Al;B、Si等两两性质相似.若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体.下列说法正确的是( )
| A、LiOH易溶于水 |
| B、电解前LiCl在加热时已发生水解 |
| C、无色气体为电解生成的H2 |
| D、Li和水反应要比Na和水剧烈 |

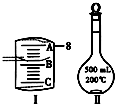 实验室要用Na2CO3?10H2O晶体配制500mL 0.1mol?L-1 Na2CO3溶液,回答下列问题:
实验室要用Na2CO3?10H2O晶体配制500mL 0.1mol?L-1 Na2CO3溶液,回答下列问题: