题目内容
8.已知:C(s)+CO2(g)═2CO(g)△H=+172.5kJ•mol-1,CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1
则 煤气化制合成气:C(s)+H2O(g)?CO(g)+H2(g) 能自发进行的条件是高温(填“高温”、“低温”或“任何温度”)
分析 根据①C(s)+CO2(g)═2CO(g)△H=+172.5kJ•mol-1,②CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1,计算反应(i)C(s)+H2O(g)?CO(g)+H2(g)的△H,该反应的△S>0,根据△G=△H-T•△S<0反应自发进行分析.
解答 解:已知:①C(s)+CO2(g)═2CO(g)△H=+172.5kJ•mol-1,②CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1,
根据盖斯定律①+②得:C(s)+H2O(g)?CO(g)+H2(g)△H=+172.5kJ•mol-1-41.0kJ•mol-1=+131.5kJ•mol-1>0,该反应的△S>0,高温时△G=△H-T•△S<0反应自发,
故答案为:高温.
点评 本题考查了反应热与焓变的应用,题目难度中等,明确判断反应自发进行的方法为解答关键,注意掌握盖斯定律的内容及应用方法.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
3.羰基硫(OCS)是一种有臭鸡蛋气味的无色气体,分子结构与CO2相似,高温下分解为CO和S.下列有关说法正确的是( )
| A. | OCS中含有1个σ键和1个π键 | |
| B. | OCS高温分解时,碳元素化合价升高 | |
| C. | OCS、CO2、CO、S晶体类型相同 | |
| D. | 22.4 L OCS中约含有3×6.02×1023个原子 |
13.已知空气-锌电池的电极反应如下:
锌电极:Zn+2OH--2e-═ZnO+H2O;
石墨电极:$\frac{1}{2}$O2+H2O+2e-═2OH-.
可以判断石墨电极是( )
锌电极:Zn+2OH--2e-═ZnO+H2O;
石墨电极:$\frac{1}{2}$O2+H2O+2e-═2OH-.
可以判断石墨电极是( )
| A. | 负极,发生还原反应 | B. | 正极,发生氧化反应 | ||
| C. | 负极,发生氧化反应 | D. | 正极,发生还原反应 |
20. 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol•L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol•L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol•L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol•L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )| A. | 曲线①代表0.1 mol•L-1KOH溶液滴定CH3COOH溶液的滴定曲线 | |
| B. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═0.05 mol•L-1 | |
| C. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) |
17.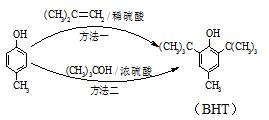 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从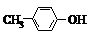 出发合成BHT的方法有如下两种.下列说法错误的是( )
出发合成BHT的方法有如下两种.下列说法错误的是( )
 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从 出发合成BHT的方法有如下两种.下列说法错误的是( )
出发合成BHT的方法有如下两种.下列说法错误的是( )| A. | 从绿色化学角度分析方法一优于方法二 | |
| B. | BHT在水中的溶解度小于苯酚 | |
| C. | 两种方法的反应类型都是加成反应 | |
| D. | BHT与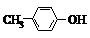 都能使酸性KMnO4溶液褪色 都能使酸性KMnO4溶液褪色 |
18.已知:乙烯可被酸性高锰酸钾溶液氧化为CO2.可以用来除去甲烷中混有的少量乙烯的操作方法是( )
| A. | 将混合气体通过盛有硫酸的洗气瓶 | |
| B. | 将混合气体通过盛有足量溴水的洗气瓶 | |
| C. | 将混合气体通过盛有水的洗气瓶 | |
| D. | 将混合气体通过盛有酸性高锰酸钾的洗气瓶 |
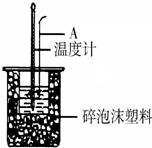 利用如图装置测定中和热的实验步骤如下
利用如图装置测定中和热的实验步骤如下