题目内容
5.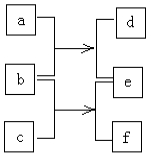 短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的单质或化合物的转化关系如图.b是金属单质,0.1mol•L-1d的pH为13,a和c是生活中常见的液态化合物,c的分子量为46.下列说法正确是( )
短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的单质或化合物的转化关系如图.b是金属单质,0.1mol•L-1d的pH为13,a和c是生活中常见的液态化合物,c的分子量为46.下列说法正确是( )| A. | 原子半径:Z>Y>X>W | |
| B. | Y与Z形成的两种常见化合物中阴阳离子个数比均为1:2 | |
| C. | b与c反应比b与a反应剧烈 | |
| D. | 元素W、Y形成的化合物的沸点一定比W、X形成的化合物高 |
分析 0.1mol•L-1d的pH为13,则d为强碱,应为NaOH,由此可知b为Na,a为H2O,e为H2,c是生活中常见的液态化合物,c的分子量为46,应为CH3CH2OH,f为CH3CH2ONa,由此可知W为H元素,X为C元素,Y为O元素,Z为Na元素,结合对应单质、化合物的性质以及元素周期律解答该题.
解答 解:由以上分析可知W为H元素,X为C元素,Y为O元素,Z为Na元素,b为Na,a为H2O,e为H2,c为,CH3CH2OH,f为CH3CH2ONa,
A.X为C元素,Y为O元素,二者位于同一周期,原子半径C>O,故A错误;
B.Y与Z形成的两种离子化合物为Na2O2或Na2O,阴阳离子的个数比均为1:2,故B正确;
C.钠与水反应较为剧烈,与乙醇反应较为平缓,故C错误;
D.C和H形成的化合物为烃,如C原子数较大,常温下可为固体,沸点大于水,故D错误,
故选B.
点评 本题考查无机物的推断,为高频考点,题目难度中等,侧重考查学生的分析能力,把握物质的性质、相互转化推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性的应用.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
16.下列有关说法中正确的是( )
| A. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离常数K(NH3•H2O)>K(HCN) | |
| B. | 室温时,相同体积、相同pH的盐酸和醋酸溶液中由水电离出的c(H+):盐酸小于醋酸溶液 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO2-4且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO2-4先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
20.化学与生活、生产密切相关,下列叙述正确的是( )
| A. | 为消除碘缺乏症,我国卫生部门规定食盐中必须加碘,其中碘元素以KI形式存在 | |
| B. | 空气污染日报中的空气污染指数的主要项目有可吸入颗粒物、二氧化硫、二氧化氮和二氧化碳 | |
| C. | 用含橙色的酸性重铬酸钾溶液的仪器检验酒驾,利用了乙醇的挥发性和还原性 | |
| D. | 为了获得更好的消毒效果,医用酒精的浓度通常为95% |
10.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | FeS2$\stackrel{O_{2}/高温}{→}$SO2$\stackrel{H_{2}O_{2}(aq)}{→}$H2SO4 | |
| B. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| C. | MgCl2(aq)$\stackrel{△}{→}$MgCl2(s)$\stackrel{电解}{→}$Mg | |
| D. | 1mol•L-1HCl(aq)$\stackrel{MnO_{2}/△}{→}$Cl2$\stackrel{石灰乳}{→}$Ca(ClO)2 |
5.一定温度下,在3个体积均为l.0L的恒容密闭容器中反应2H2(g)+CO(g)?CH3OH(g)分别达到平衡.下列说法正确的是( )
| 容器 | 温度(K) | 起始浓度(mol/L) | CH3OH的平衡浓度(mol/L) | ||
| H2 | CO | CH3OH | |||
| ① | 400 | 0.20 | 0.10 | 0 | 0.08 |
| ② | 400 | 0.40 | 0.20 | 0 | x |
| ③ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应是吸热反应 | |
| B. | X=0.16 | |
| C. | 平衡时,容器②中H2的体积分数比容器①的大 | |
| D. | 400K时若再向容器①中充入0.10molH2、0.10molCO和0.10molCH3OH,则平衡将向正反应方向移动 |
2.下列有关性质的比较,不正确的是( )
| A. | 氧化性强弱:F2>Cl2>Br2 | B. | 非金属性:O>S>Se | ||
| C. | 还原性强弱:F->Cl->I- | D. | 碱性强弱:KOH>NaOH>LiOH |


 镁是一种重要的金属资源,在各领域都具有重要的作用.
镁是一种重要的金属资源,在各领域都具有重要的作用. (W是链接中的部分结构)是一类重要的功能高分子材料,聚合物X是其中的一种,转化路线如下
(W是链接中的部分结构)是一类重要的功能高分子材料,聚合物X是其中的一种,转化路线如下


 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2 NaBr+2 H2O
+2 NaBr+2 H2O
 或
或 ,(写出其中一种即可)
,(写出其中一种即可)