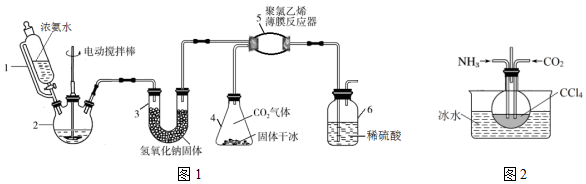
题目内容
10.在给定的条件下,下列选项所示的物质间转化均能实现的是( )| A. | FeS2$\stackrel{O_{2}/高温}{→}$SO2$\stackrel{H_{2}O_{2}(aq)}{→}$H2SO4 | |
| B. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| C. | MgCl2(aq)$\stackrel{△}{→}$MgCl2(s)$\stackrel{电解}{→}$Mg | |
| D. | 1mol•L-1HCl(aq)$\stackrel{MnO_{2}/△}{→}$Cl2$\stackrel{石灰乳}{→}$Ca(ClO)2 |
分析 A.FeS2与氧气在高温下反应生成二氧化硫,二氧化硫可以被双氧水氧化成硫酸;
B.硫酸铜溶液与钠反应不会生成金属铜;
C.HCl易挥发,直接加热氯化镁溶液无法达到氯化镁固体;
D.1mol/L的HCl(aq)为稀盐酸,稀盐酸不与二氧化锰反应.
解答 解:A.FeS2在高温下与O2反应生成SO2,SO2具有还原性,能够被双氧水氧化成H2SO4,转化关系FeS2$\stackrel{O_{2}/高温}{→}$SO2$\stackrel{H_{2}O_{2}(aq)}{→}$H2SO4能够实现,故A正确;
B.CuSO4与Na反应生成硫酸钠、氢气和氢氧化铜,不会置换出Cu,则CuSO4(aq)$\stackrel{Na}{→}$Cu无法实现,故B错误;
C.氯化氢具有挥发性,加热氯化镁溶液得到的是氢氧化镁,无法获得MgCl2(s),则MgCl2(aq)$\stackrel{△}{→}$MgCl2(s)无法实现,故C错误;
D.1mol•L-1HCl(aq)为稀盐酸,二氧化锰不与稀盐酸反应,则1mol•L-1HCl(aq)$\stackrel{MnO_{2}/△}{→}$Cl2无法实现,故D错误;
故选A.
点评 本题考查常见金属及其化合物性质,题目难度中等,涉及氯气、硫酸的制备、盐的水解原理、金属及其化合物性质等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析、理解能力.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
1.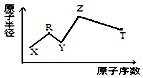 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是( )
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | Y的单质易与R、T的氢化物反应 | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |
18.减少CO2的排放以及CO2的资源化利用具有重要意义.
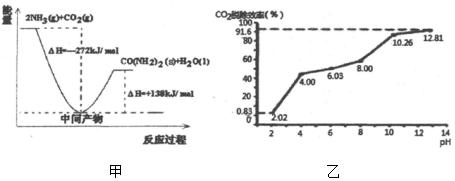
(1)H2NCOONH4是工业合成尿素[CO(NH2)2]的中间产物,该反应的能量变化示意图如图甲所示,用CO2和氨气合成尿素的热化学方程式为CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol.
(2)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一.
①写出氨水捕集烟气中的CO2生成碳酸氢铵的主要化学方程式CO2+NH3.H2O=NH4HCO3.
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图乙所示,烟气中CO2的含量为12%,烟气通入氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为0.13mol(精确到0.01).
③通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成CO2.
(3)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H=-90kJ/mol.在T1℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应过程如下图所示.
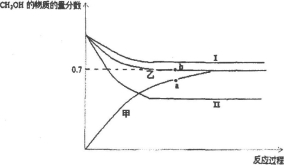
①能代表丙反应的曲线是I(选填I、II),a、b点的压强关系为Pa>Pb(填>、<、=),理由是平衡时a点甲醇的物质的量分数小,则总物质的量大.
②b点时反应吸收的能量为11.25kJ.

(1)H2NCOONH4是工业合成尿素[CO(NH2)2]的中间产物,该反应的能量变化示意图如图甲所示,用CO2和氨气合成尿素的热化学方程式为CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol.
(2)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一.
①写出氨水捕集烟气中的CO2生成碳酸氢铵的主要化学方程式CO2+NH3.H2O=NH4HCO3.
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图乙所示,烟气中CO2的含量为12%,烟气通入氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为0.13mol(精确到0.01).
③通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成CO2.
(3)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H=-90kJ/mol.在T1℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应过程如下图所示.

| 容器 | 甲 | 乙 | 丙 |
| 起始反应物投入量 | 2molH2、1molCO | 1molCH3OH | 2mol CH3OH |
②b点时反应吸收的能量为11.25kJ.
5.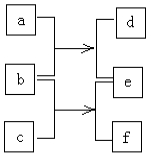 短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的单质或化合物的转化关系如图.b是金属单质,0.1mol•L-1d的pH为13,a和c是生活中常见的液态化合物,c的分子量为46.下列说法正确是( )
短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的单质或化合物的转化关系如图.b是金属单质,0.1mol•L-1d的pH为13,a和c是生活中常见的液态化合物,c的分子量为46.下列说法正确是( )
 短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的单质或化合物的转化关系如图.b是金属单质,0.1mol•L-1d的pH为13,a和c是生活中常见的液态化合物,c的分子量为46.下列说法正确是( )
短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的单质或化合物的转化关系如图.b是金属单质,0.1mol•L-1d的pH为13,a和c是生活中常见的液态化合物,c的分子量为46.下列说法正确是( )| A. | 原子半径:Z>Y>X>W | |
| B. | Y与Z形成的两种常见化合物中阴阳离子个数比均为1:2 | |
| C. | b与c反应比b与a反应剧烈 | |
| D. | 元素W、Y形成的化合物的沸点一定比W、X形成的化合物高 |
3.联苯(结构如图所示 ),碳碳单键可以旋转)的二氯代物有( )
),碳碳单键可以旋转)的二氯代物有( )
 ),碳碳单键可以旋转)的二氯代物有( )
),碳碳单键可以旋转)的二氯代物有( )| A. | 9种 | B. | 12种 | C. | 20种 | D. | 24种 |
10.下列关于物质性质变化的比较,不正确的是( )
| A. | 金属性Na>Mg>Al | B. | 原子半径大小:S>Cl>F | ||
| C. | 稳定性 PH3>H2S>HF | D. | 碱性强弱:KOH>NaOH>LiOH |
7.下列物质中,属于共价化合物的是( )
| A. | Na2S | B. | NH4NO3 | C. | H2 | D. | CS2 |
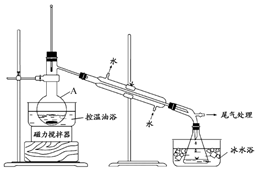 1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm-3.实验室制备少量1-溴丙烷的主要步骤如下:
1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm-3.实验室制备少量1-溴丙烷的主要步骤如下: