题目内容
8.NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 2 L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
分析 A、重水的摩尔质量为20g/mol;
B、亚硫酸为弱酸;
C、过氧化钠和水反应生成氧气时,氧元素的价态由-1价变为0价;
D、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4.
解答 解:A、重水的摩尔质量为20g/mol,故18g重水的物质的量为0.9mol,则含有9NA个质子,故A错误;
B、亚硫酸为弱酸,不能完全电离,故溶液中的氢离子的个数小于2NA个,故B错误;
C、过氧化钠和水反应生成氧气时,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时,转移0.2NA个电子,故C正确;
D、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减小,故产物分子个数小于2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.从下列实验事实所引出的相应结论正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越长 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
| B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
| C | H+浓度相同的盐酸和硫酸分别与等质量的形状相同的锌粒反应 | 反应开始速率相同 |
| D | 在容积可变的密闭容器中发生反应H2(g)+I2(g)?2HI(g),把容积缩小一倍 | 反应速率不变 |
| A. | A | B. | B | C. | C | D. | D |
19.下列事实能说明氯元素原子得电子能力比硫元素强的是( )
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S强
④HCl的还原性比H2S强
⑤HClO的酸性比H2SO4强
⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
⑦Cl2能与H2S反应生成S
⑧还原性:Cl-<S2-.
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S强
④HCl的还原性比H2S强
⑤HClO的酸性比H2SO4强
⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
⑦Cl2能与H2S反应生成S
⑧还原性:Cl-<S2-.
| A. | ③④⑤⑦⑧ | B. | ③⑥⑦ | C. | ③⑥⑦⑧ | D. | ①②③④⑤⑥⑦⑧ |
20.下列根据元素周期表和元素周期律得出的推断中正确的是( )
| A. | 金属元素原子最外层电子数越少,该金属失电子能力越强 | |
| B. | 铅位于周期表中金属和非金属的交界处,可作半导体材料 | |
| C. | aA2+、bB+、cC3-三种离子具有相同的电子层结构,则原子序数c>a>b | |
| D. | 若存在简单阴离子R2-,则R一定位于ⅥA族 |
18.同主族元素所形成的同一类型的化合物,其结构和性质往往相似,下列对化合物PH4I的描述中不正确的是( )
| A. | 它是一种共价化合物 | B. | 在加热时此化合物可以分解 | ||
| C. | 这种化合物不能跟碱发生反应 | D. | 该化合物可以由PH3跟HI化合而成 |
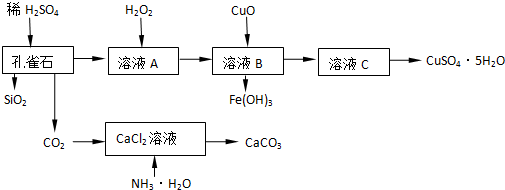
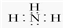 ;
;