题目内容
3.A、B、C、D 4种元素,其中A、B、C为短周期元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.(1)B元素的名称氮;B在周期表中的位置第二周期,第第ⅤA族族;
(2)A、B形成的化合物的电子式
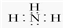 ;
;(3)C的元素符号S,C的最高价氧化物的化学式SO3;
(4)D的最高价氧化物对应的水化物的化学式KOH.
分析 A、B、C、D四种元素,A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,则B为N元素;C元素原子的最外层电子数比次外层少2个,则C应有三个电子层,最外层电子数为6,即C为S元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,D在第四周期第ⅠA族,即D为K,据此进行解答.
解答 解:A、B、C、D四种元素,A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,则B为N元素;C元素原子的最外层电子数比次外层少2个,则C应有三个电子层,最外层电子数为6,即C为S元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,D在第四周期第ⅠA族,即D为K,
(1)由上述推断可知,B为氮元素,原子序数为7,处于周期表中第二周期第ⅤA族,
故答案为:氮;二;第ⅤA族;
(2)A、B形成的化合物为NH3,氨气为共价化合物,其电子式为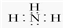 ,
,
故答案为: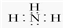 ;
;
(3)由上述推断可知,C为S元素,S的最高价为+6价,则最高价氧化物为SO3,
故答案为:S;SO3;
(4)D为K元素,K的最高价为+1价,则D的最高价氧化物对应的水化物的化学式为KOH,
故答案为:KOH.
点评 本题考查结构性质位置关系应用,题目难度中等,推断元素是解题关键,侧重对化学用语的考查,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题有利于提高学生的逻辑推理能力.

练习册系列答案
相关题目
13.与乙烯是同系物的是( )
| A. | 甲烷 | B. | 甲苯 | C. | 丙炔 | D. | 戊烯 |
14.下列实验操作能达到实验目的是( )
| A. | 用长颈漏斗分离出乙酸与乙醇反应的产物 | |
| B. | 用向上排空气法收集铜粉与稀硝酸反应产生的NO | |
| C. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| D. | 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
18.下列离子方程式书写正确的是( )
| A. | 氧化铜与盐酸反应:O2-+2H+=H2O | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3+2HClO | |
| C. | 大理石跟盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 醋酸和氨水反应:H++OH-=H2O |
8.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 2 L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
15.下列各组离子一定能大量共存的是( )
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl- |
12.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )
| A. | 同一族元素的原子最外层电子数相同 | |
| B. | 目前使用的长式元素周期表中,最长的周期含36种元素 | |
| C. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
13.下列变化,是通过取代反应来实现的是( )
| A. | CH3CH2OH→CH3CHO | B. | CH2=CH2→CH3-CH2Br | ||
| C. |  | D. | CH3CH2OH→CH3COOH |

 或
或 .
.