题目内容
A、B、C、D四种短周期元素.原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲;D的L层电子数等于K、M两个电子层上的电子数之和.
(1)写出下列元素的名称:A ,B ,C ,D .
(2)D的质子数和中子数相等,D的原子组成符号为 ,它的最高价为 价.
(3)用电子式表示A、D两元素形成AD2的过程: ;写出C2B2的电子式 .
(4)氢元素与B、D 均可以形成原子个数比为2:1的化合物,H2B的熔沸点高于H2D的原因是 .
(5)写出甲和A的最高价氧化物反应的化学方式: .
(1)写出下列元素的名称:A
(2)D的质子数和中子数相等,D的原子组成符号为
(3)用电子式表示A、D两元素形成AD2的过程:
(4)氢元素与B、D 均可以形成原子个数比为2:1的化合物,H2B的熔沸点高于H2D的原因是
(5)写出甲和A的最高价氧化物反应的化学方式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲,则固体甲为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,据此解答.
解答:
解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲,则固体甲为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,
(1)由上述分析可知,A为C元素、B为O元素、C为Na元素、D为S元素,故答案为:碳;氧;钠;硫;
(2)D为硫元素,质子数和中子数相等都为16,S的原子组成符号为 3216S,它的最高价为+6价,故答案为:3216S;+6;
(3)AD2为CS2,用电子式表示它的形成过程为 ,C2B2为过氧化钠,它的电子式为
,C2B2为过氧化钠,它的电子式为 ,故答案为:
,故答案为: ;
; ;
;
(4)因为水分子间存在氢键,所以H2O的熔沸点高于H2S,故答案为:水分子间存在氢键;
(5)甲为过氧化钠,A的最高价氧化物为二氧化碳,它们反应的化学方式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(1)由上述分析可知,A为C元素、B为O元素、C为Na元素、D为S元素,故答案为:碳;氧;钠;硫;
(2)D为硫元素,质子数和中子数相等都为16,S的原子组成符号为 3216S,它的最高价为+6价,故答案为:3216S;+6;
(3)AD2为CS2,用电子式表示它的形成过程为
 ,C2B2为过氧化钠,它的电子式为
,C2B2为过氧化钠,它的电子式为 ,故答案为:
,故答案为: ;
; ;
; (4)因为水分子间存在氢键,所以H2O的熔沸点高于H2S,故答案为:水分子间存在氢键;
(5)甲为过氧化钠,A的最高价氧化物为二氧化碳,它们反应的化学方式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
点评:本题主要考查了原子结构、电子式、氢键、化学方程式等知识点,难度不大,解题目的关键在于根据原子结构和物质的性质确定元素种类,答题时注意化学用语的规范表达.

练习册系列答案
相关题目
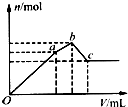 向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )
向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )| A、a点的沉淀总物质的量为0.03mol |
| B、Oa段发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、ab段发生反应的离子方程式是:2NH42++SO42-+Ba2++2OH-═2NH3?H2O+BaSO4↓ |
| D、反应到c点时,加入Ba(OH)2溶液的总体积为250mL |

 某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程.
某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程.