题目内容
某化学兴趣小组对镁与盐酸的反应进行实验探究,实验数据如下:
(1)该实验中影响镁与盐酸反应速率的因素是 .
(2)曲线c是由实验 (填序号)得到的数据.
(3)反应进行1min时,生成氢气最多的是实验 (填序号).
(4)若要求实验①的反应速率与实验②的反应速率相同(使用的药品不变),可采取的是 .
| 实验编号 | 镁的质量 | 镁的规格 | 盐酸的体积 | 盐酸的浓度 | 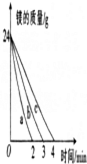 |
| ① | 24g | 镁条 | 500mL | 6mol?L-1 | |
| ② | 24g | 24g镁条 剪成100段 | 500mL | 6mol?L-1 | |
| ③ | 24g | 镁粉 | 500mL | 6mol?L-1 |
(2)曲线c是由实验
(3)反应进行1min时,生成氢气最多的是实验
(4)若要求实验①的反应速率与实验②的反应速率相同(使用的药品不变),可采取的是
考点:探究影响化学反应速率的因素
专题:实验设计题,化学反应速率专题
分析:(1)影响化学反应速率的因素:温度、浓度、催化剂、固体表面积,据表中的实验数据回答;
(2)根据图示信息知道,反应速率是a>b>c,据此回答;
(3)反应进行1min时,生成氢气最多的即反应的速率最快的,据影响化学反应速率的因素回答;
(4)实验1和实验2的区别是镁和盐酸的接触面积不一样,实验2的反应速率要快于1的.
(2)根据图示信息知道,反应速率是a>b>c,据此回答;
(3)反应进行1min时,生成氢气最多的即反应的速率最快的,据影响化学反应速率的因素回答;
(4)实验1和实验2的区别是镁和盐酸的接触面积不一样,实验2的反应速率要快于1的.
解答:
解:(1)根据表中的实验数据,盐酸的浓度是一样的,金属镁的质量是一样的,但是金属镁的表面积不同,所以影响镁与盐酸反应速率的因素是镁的表面积,故答案为:镁的表面积;
(2)根据图示信息知道,反应速率是a>b>c,根据表中的实验数据,盐酸的浓度是一样的,金属镁的质量是一样的,但是金属镁的表面积不同,表面积:实验1>实验2>实验1,所以实验2的速率快于实验1,即曲线c是由实验①得到的数据,故答案为:①;
(3)反应进行1min时,生成氢气最多的即反应的速率最快的,根据②的分析,所以生成氢气最多的是实验③,故答案为:③;
(4)实验1和实验2的区别是镁和盐酸的接触面积不一样,实验2的反应速率要快于1的,若要求实验①的反应速率与实验②的反应速率相同,可以升高实验①的温度,提高实验1的反应速率,故答案为:升高实验①的温度.
(2)根据图示信息知道,反应速率是a>b>c,根据表中的实验数据,盐酸的浓度是一样的,金属镁的质量是一样的,但是金属镁的表面积不同,表面积:实验1>实验2>实验1,所以实验2的速率快于实验1,即曲线c是由实验①得到的数据,故答案为:①;
(3)反应进行1min时,生成氢气最多的即反应的速率最快的,根据②的分析,所以生成氢气最多的是实验③,故答案为:③;
(4)实验1和实验2的区别是镁和盐酸的接触面积不一样,实验2的反应速率要快于1的,若要求实验①的反应速率与实验②的反应速率相同,可以升高实验①的温度,提高实验1的反应速率,故答案为:升高实验①的温度.
点评:本题是一道关于影响化学反应速率的实验探究题,注意控制变量法在实验中的应用是关键,难度中等.

练习册系列答案
相关题目
 某学生利用C、N、0三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )
某学生利用C、N、0三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )| A、该分子的分子式为CNO3 |
| B、分子中既含极性键又含非极性键 |
| C、C、N的化合价分别为+4、+3 |
| D、C、N、0的第一电离能依次增大 |
已知:H2C2O4、KMnO4、H2SO4混合发生反应:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.某同学根据上述原理和溶液褪色时间,设计实验测定反应速率,实验记录如下表(各实验均在室温下进行):下列结论正确的是( )
| 实验编号 | 烧杯中所加的试剂及其用量(mL) | 加入少 量固体 | 溶液褪色 时间(s) | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | |||
| 1 | 30.0 | 20.0 | 30.0 | 20.0 | 无 | 1.8 |
| 2 | 15.0 | 15.0 | 10.0 | 无 | 3.6 | |
| 3 | 30.0 | 20.0 | 30.0 | 20.0 | K2SO4 | 1.8 |
| 4 | 30.0 | 20.0 | 30.0 | 20.0 | MnSO4 | 0.6 |
| A、实验3、4说明K+对该反应有催化作用 |
| B、实验2中x=10 |
| C、实验1、2说明反应速率只与KMnO4浓度有关 |
| D、实验1、4可推出实验1中反应速率变化:起初较小,后明显变大,又逐渐变小 |
“物质的量”是指( )
| A、物质的质量 |
| B、物质的微观粒子数 |
| C、物质的质量与微观粒子数 |
| D、能把物质的质量同微观粒子数联系起来的一个基本物理量 |




 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下: