题目内容
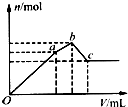 向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )
向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )| A、a点的沉淀总物质的量为0.03mol |
| B、Oa段发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、ab段发生反应的离子方程式是:2NH42++SO42-+Ba2++2OH-═2NH3?H2O+BaSO4↓ |
| D、反应到c点时,加入Ba(OH)2溶液的总体积为250mL |
考点:离子方程式的有关计算
专题:
分析:100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol、Al3+0.01mol、SO42-0.02mol;
开始滴入氢氧化钡溶液后同时发生反应为:SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到a)
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为:SO42-+Ba2+=BaSO4↓、NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;(a到b)
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液(b到c),据此进行解答.
开始滴入氢氧化钡溶液后同时发生反应为:SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到a)
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为:SO42-+Ba2+=BaSO4↓、NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;(a到b)
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液(b到c),据此进行解答.
解答:
解:100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为:0.1mol/L×0.1L=0.01mol,0.01molNH4Al(SO4)2溶液含有NH4+0.01mol、Al3+0.01mol、SO42-0.02mol;
开始滴入氢氧化钡溶液后同时发生反应:SO42-+Ba2+=BaSO4↓、Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-没有完全沉淀,此时溶液含有硫酸铵、硫酸铝;(O→a)
再滴加Ba(OH)2,发生反应为:SO42-+Ba2+=BaSO4↓、NH4++OH-=NH3?H2O,所以沉淀质量继续增加,但增加幅度较前一过程小;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入了0.04molOH-,Al3+消耗了0.03molOH-生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,溶液中NH4+完全反应,此时溶液为氨水溶液,沉淀达最大为BaSO4和Al(OH)3;(a→b);
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液,(b→c)
A.根据分析可知,从开始到a点,发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,a点对应的沉淀为BaSO4和Al(OH)3,物质的量之和为:0.01mol+0.015mol=0.025mol,故A错误;
B.Oa段铝离子完全沉淀,硫酸根离子部分沉淀,发生反应的离子方程式是:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,故B错误;
C.由分析可知,ab段发生反应的离子方程式是:2NH42++SO42-+Ba2++2OH-═2NH3?H2O+BaSO4↓,故C正确;
D、由分析可知,c点加入Ba(OH)2的物质的量为0.005mol+0.02mol=0.025mol,所以
=0.25L=250ml,故D正确;
故选CD.
开始滴入氢氧化钡溶液后同时发生反应:SO42-+Ba2+=BaSO4↓、Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-没有完全沉淀,此时溶液含有硫酸铵、硫酸铝;(O→a)
再滴加Ba(OH)2,发生反应为:SO42-+Ba2+=BaSO4↓、NH4++OH-=NH3?H2O,所以沉淀质量继续增加,但增加幅度较前一过程小;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入了0.04molOH-,Al3+消耗了0.03molOH-生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,溶液中NH4+完全反应,此时溶液为氨水溶液,沉淀达最大为BaSO4和Al(OH)3;(a→b);
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液,(b→c)
A.根据分析可知,从开始到a点,发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,a点对应的沉淀为BaSO4和Al(OH)3,物质的量之和为:0.01mol+0.015mol=0.025mol,故A错误;
B.Oa段铝离子完全沉淀,硫酸根离子部分沉淀,发生反应的离子方程式是:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,故B错误;
C.由分析可知,ab段发生反应的离子方程式是:2NH42++SO42-+Ba2++2OH-═2NH3?H2O+BaSO4↓,故C正确;
D、由分析可知,c点加入Ba(OH)2的物质的量为0.005mol+0.02mol=0.025mol,所以
| 0.025mol |
| 0.1mol/L |
故选CD.
点评:本题考查铝化合物的性质及计算,难度比较大,清楚整个反应过程是解题的关键,注意NH4+与Al3+同时存在,OH-首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH-首先与NH4+反应,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
T1温度下的部分实验数据为:下列说法不正确的是( )
T1温度下的部分实验数据为:下列说法不正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500s内N2O5分解速率为2.96×10-3 mol/(L?s) |
| B、T1温度下的平衡常数为K1=125,1000s时转化率为50% |
| C、其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 |
| D、T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若T1>T3,则K1>K3 |
下列推论正确的是( )
| A、H2(g)的燃烧热是285.8 kJ?mol-1,则H2O(g)=2H2(g)+O2(g)△H=+285.8 kJ?mol-1 |
| B、对于反应2H2O2═2H2O+O2↑,升高温度能加快O2的生成速率 |
| C、已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| D、在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl-?[CuCl4]2-(绿)+4H2O,若向溶液中滴加足量AgNO3溶液,可使溶液呈现绿色 |
区分晶体和非晶体的最可靠的科学方法是( )
| A、测定熔沸点的高低 |
| B、对固体进行X射线衍射 |
| C、看是否有规则的几何外形 |
| D、比较硬度 |
aXm+、bYn+、cZm-、dQn-(m>n)的电子层结构相同,下列说法正确的是( )
| A、原子半径的大小顺序为:X>Y>Z>Q |
| B、离子半径的大小顺序为:Xm+>Yn+>Zm->Qn- |
| C、m+a=d-n |
| D、b-n=c+m |
 (1)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同].)
(1)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同].)


