题目内容
某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO,从该矿石中提取钴的主要工艺流程如下:
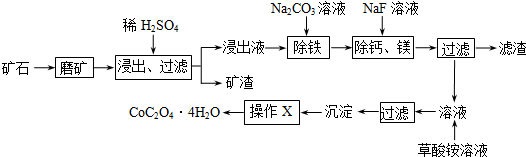
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示.考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃.

(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+H2O+Na2CO3═Na2Fe6(SO4)4(OH)12↓+Na2SO4+CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF═MgF2↓+Na2SO4;CaSO4+2NaF═CaF2↓+Na2SO4.已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的
= .
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 .
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+C6
CoO2+LiC6.LiC6中Li的化合价为 价.若放电时有1mol e-转移,正极质量增加 g.

(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示.考虑生产成本和效率,最佳的浸出时间为

(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+H2O+Na2CO3═Na2Fe6(SO4)4(OH)12↓+Na2SO4+CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF═MgF2↓+Na2SO4;CaSO4+2NaF═CaF2↓+Na2SO4.已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的
| c(Ca2+) |
| c(Mg2+) |
(4)“沉淀”中含杂质离子主要有
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+C6
| 充电 |
| 放电 |
考点:物质分离和提纯的方法和基本操作综合应用,化学电源新型电池,难溶电解质的溶解平衡及沉淀转化的本质
专题:实验设计题,电化学专题
分析:(1)根据浸出率与时间和温度的关系及生产成本分析;
(2)根据原子守恒配平方程式;
(3)
=
;
(4)根据流程图中加入的物质分析,该沉淀中吸附易溶于水的离子;得到的沉淀要进行洗涤和干燥,才能得到较纯净、干燥的物质;
(5)放电时,该电池是原电池,正极上得电子发生还原反应,依据负极电极材料和题干信息分析计算.
(2)根据原子守恒配平方程式;
(3)
| c(Ca2+) |
| c(Mg2+) |
| Ksp(CaF2) |
| Ksp(MgF2) |
(4)根据流程图中加入的物质分析,该沉淀中吸附易溶于水的离子;得到的沉淀要进行洗涤和干燥,才能得到较纯净、干燥的物质;
(5)放电时,该电池是原电池,正极上得电子发生还原反应,依据负极电极材料和题干信息分析计算.
解答:
解:(1)根据图知,时间越长浸出率越高,温度越高,浸出率越高,但浸出12小时后,浸出率变化不大,90℃和120℃浸出率变化不大,且时间过长、温度过高导致成本较大,所以最佳的浸出时间为12小时,最佳的浸出温度为90℃,故答案为:12;90;
(2)根据原子守恒配平方程式,所以其方程式为:3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6 (SO4)4(OH)12↓+5Na2SO4+6CO2↑,故答案为:3,6,6,1,5,6;
(3)
=
=
=1.5,故答案为:1.5;
(4)该沉淀中吸附易溶于水的离子,根据流程图知,溶液中含有铵根离子和钠离子,所以沉淀上含有铵根离子和钠离子,得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质,故答案为:SO42-、NH4+、Na+;洗涤;干燥;
(5)放电时,该电池是原电池,正极上得电子发生还原反应,电极反应式为:CoO2+Li++e-=LiCoO2,充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,所以负极为LiC6中Li的化合价为0价,若放电时有1mol e-转移,CoO2+Li++e-=LiCoO2,正极质量增加为1molLi+的质量=1mol×7g/mol=7g;
故答案为:0,7g;
(2)根据原子守恒配平方程式,所以其方程式为:3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6 (SO4)4(OH)12↓+5Na2SO4+6CO2↑,故答案为:3,6,6,1,5,6;
(3)
| c(Ca2+) |
| c(Mg2+) |
| Ksp(CaF2) |
| Ksp(MgF2) |
| 1.1×10-10 |
| 7.40×10-11 |
(4)该沉淀中吸附易溶于水的离子,根据流程图知,溶液中含有铵根离子和钠离子,所以沉淀上含有铵根离子和钠离子,得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质,故答案为:SO42-、NH4+、Na+;洗涤;干燥;
(5)放电时,该电池是原电池,正极上得电子发生还原反应,电极反应式为:CoO2+Li++e-=LiCoO2,充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,所以负极为LiC6中Li的化合价为0价,若放电时有1mol e-转移,CoO2+Li++e-=LiCoO2,正极质量增加为1molLi+的质量=1mol×7g/mol=7g;
故答案为:0,7g;
点评:本题考查难溶电解质的溶解平衡、电极反应式的书写、物质的分离和提纯等知识点,难点是(3)题,明确溶度积常数的含义是解此题关键,电极反应式的书写是学习难点,要结合电解质溶液的酸碱性书写,难度中等.

练习册系列答案
相关题目
aXm+、bYn+、cZm-、dQn-(m>n)的电子层结构相同,下列说法正确的是( )
| A、原子半径的大小顺序为:X>Y>Z>Q |
| B、离子半径的大小顺序为:Xm+>Yn+>Zm->Qn- |
| C、m+a=d-n |
| D、b-n=c+m |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、1mol乙基(-C2H5)中含有的电子数为17NA |
| B、标准状况下,22.4L氯仿(三氯甲烷)中共价键数目为4NA |
| C、1L pH=1的稀硫酸中有0.2 NA个H+ |
| D、78gNa2O2中含有2NA个阴离子(相对原子质量:Na-23 O-16) |
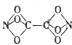 某学生利用C、N、0三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )
某学生利用C、N、0三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )| A、该分子的分子式为CNO3 |
| B、分子中既含极性键又含非极性键 |
| C、C、N的化合价分别为+4、+3 |
| D、C、N、0的第一电离能依次增大 |
硝酸见光发生如下分解反应:4HNO3═2H2O+4X↑+O2↑,则X的化学式为( )
| A、SO2 |
| B、N2O |
| C、NO |
| D、NO2 |
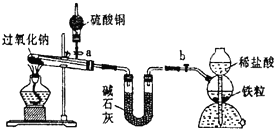 Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.