题目内容
7.取6.9克碳酸钾溶于水配制成10ml溶液,则此溶液中钾离子物质的量浓度为多少?分析 求出碳酸钾的物质的量,然后根据c=$\frac{n}{V}$计算其浓度,而钾离子的物质的量浓度是碳酸钾浓度的2倍,据此计算.
解答 解:6.9g碳酸钾的物质的量n=$\frac{6.9g}{138g/mol}$=0.05mol,故所得溶液的物质的量浓度c=$\frac{0.05mol}{0.01L}$=5mol/L.
而溶液中钾离子的浓度是碳酸钾浓度的2倍,故溶液中钾离子的浓度为5mol/L×2=10mol/L,
答:溶液中钾离子的物质的量浓度为10mol/L.
点评 本题考查物质的量浓度的计算,侧重于学生的分析、计算能力的考查,注意相关计算公式的运用,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.在2A+B═3C+4D反应中,下面表示的反应速率最快的是( )
| A. | VA=3.0mol•L-1•min-1 | B. | VB=0.2mol•L-1•s-1 | ||
| C. | VC=4.8mol•L-1•min-1 | D. | VD=4.0mol•L-1•min-1 |
15.下列各项中表达正确的是考( )
| A. | 基态氧原子核外价电子的轨道表示式: | |
| B. | HClO的结构式为H-Cl-O | |
| C. | 用电子式表示NaCl的形成过程: | |
| D. | F-的结构示意图: |
2.某溶液,由Na+、Ba2+、Al3+、AlO2-、CrO42-、CO32-、SO42-中的若干种组成.取适量该溶液进行如下实验:①加入过量盐酸有气体生成并得到无色溶液;②在①所得溶液中再加入过量NH4HCO3溶液,有气体生成并析出白色沉淀甲;③在②所得溶液中加入过量Ba(OH)2溶液也有气体生成并产生白色沉淀乙,则原沉淀中一定存在的离子是( )
| A. | Na+、AlO2-、CrO42-、CO32- | B. | Na+、AlO2-、CO32- | ||
| C. | Na+、AlO2-、CO32-、SO42- | D. | Na+、Ba2+、AlO2-、CO32- |
12.已知:2Na[Al(OH)4]+CO2+3H2O=2Al(OH)3↓+Na2CO3.向含2mol NaOH、1mol Ba(OH)2、2mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系不正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 6 | 4 | 3 | 2 |
| n(沉淀)(mol) | 2 | 3 | 2 | 1 |
| A. | A | B. | B | C. | C | D. | D |
19.有A、B、C、D四种金属,投入水中只有D反应放出氢气,将A投入C的盐溶液中可置换出金属C,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,则四种金属的金属性强弱顺序正确的是( )
| A. | A>B>C>D | B. | D>B>A>C | C. | D>A>C>B | D. | C>A>B>D |
16.醋酸溶液中存在电离平衡:CH3COOH?H++CH3COO-下列叙述不正确的是( )
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| B. | CH3COOH溶液加醋酸钠溶液,因醋酸根水解显碱性,电离平衡向正反应方向移动 | |
| C. | CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动 | |
| D. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
 ,该氢化物可以与H+离子以配位键相合,产物的结构式
,该氢化物可以与H+离子以配位键相合,产物的结构式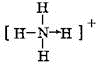 .
. ,1mol O22+中含有的π键为2mol.
,1mol O22+中含有的π键为2mol.