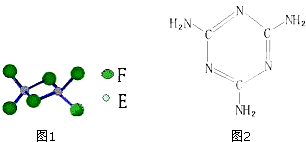
题目内容
2.某溶液,由Na+、Ba2+、Al3+、AlO2-、CrO42-、CO32-、SO42-中的若干种组成.取适量该溶液进行如下实验:①加入过量盐酸有气体生成并得到无色溶液;②在①所得溶液中再加入过量NH4HCO3溶液,有气体生成并析出白色沉淀甲;③在②所得溶液中加入过量Ba(OH)2溶液也有气体生成并产生白色沉淀乙,则原沉淀中一定存在的离子是( )| A. | Na+、AlO2-、CrO42-、CO32- | B. | Na+、AlO2-、CO32- | ||
| C. | Na+、AlO2-、CO32-、SO42- | D. | Na+、Ba2+、AlO2-、CO32- |
分析 ①加入过量盐酸有气体生成并得到无色溶液,气体应该是CO2,所以一定含有CO32-,则就一定没有Ba2+、Al3+,因此根据溶液的电中性可知,一定有钠离子.又因为溶液是无色的,所以没有CrO42-;
②在①所得溶液中再加入过量NH4HCO3溶液,有气体生成并析出白色沉淀甲,该气体是氨气,沉淀只能是氢氧化铝,这说明原溶液中含有AlO2-;
③在②所得溶液中加入过量Ba(OH)2溶液也有气体生成并产生白色沉淀乙,由于碳酸氢铵是过量的,一定能生成气体氨气和白色沉淀碳酸钡,因此不能确定SO42-,据此进行解答.
解答 解:根据①可知,气体应该是CO2,所以一定含有CO32-,则就一定没有Ba2+、Al3+,因此根据溶液的电中性可知,一定有钠离子.又因为溶液是无色的,所以没有CrO42-;
根据②可知,气体是氨气,沉淀只能是氢氧化铝,这说明原溶液中含有AlO2-;由于碳酸氢铵是过量的,所以根据③可知,一定能生成气体氨气和白色沉淀碳酸钡,因此不能确定SO42-,
根据分析可知,原溶液中一定含有的离子为:Na+、AlO2-、CO32-,
故选B.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质及检验方法为解答关键,注意检验离子存在时,必须排除干扰,确保检验方案的严密性,试题有利于培养学生的分析能力及逻辑推理能力.

练习册系列答案
相关题目
8.下列溶液中,氯离子浓度最大的是( )
| A. | 200mL 1mol/L的NaCl溶液 | B. | 150 mL 1mol/L的MgCl2溶液 | ||
| C. | 100mL 1mol/L的HCl溶液 | D. | 50mL 1mol/L的AlCl3溶液 |
13.下面四种变化中,有一种变化与其他三种变化类型不同的是( )
| A. | CH3CH2OH+CH3COOH $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| C. | 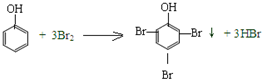 | |
| D. | CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O |
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 2.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.04NA | |
| C. | 7.8g Na2S和Na2O2的固体混合物中含有的阴离子数等于0.1NA | |
| D. | 常温下,5.6 g 铁钉与足量浓硝酸反应,转移的电子数为0.3 NA |
12.点燃一根蜡烛,用冷碟底放在蜡烛火焰上方,过一会儿,在碟底收集到炭黑,由此能得出石蜡的组成中一定含有( )
| A. | 碳元素 | B. | 氢元素 | C. | 氧元素 | D. | 氢、氧元素 |