题目内容
3.对溶液中的离子进行鉴定,下列实验所得结论不合理的是( )| A. | 溶液中加入HCl酸化后,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42- | |
| B. | 溶液中加入KSCN溶液,无红色出现,继续加入氯水,溶液变红,说明溶液中一定含有Fe2+ | |
| C. | 溶液中加入NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推测该溶液中含有NH4+ | |
| D. | 向溶液中加入盐酸,有使澄清石灰水变浑浊的无色无味的气体放出,可推测溶液中含有CO32- |
分析 A.加入HCl酸化后,排除银离子、碳酸根离子等干扰;
B.加入KSCN溶液,无红色出现,不含铁离子,继续加入氯水,溶液变红,可知亚铁离子被氧化为铁离子;
C.氨气能使湿润的红色石蕊试纸变蓝;
D.气体为二氧化碳,原溶液可能含HCO3-.
解答 解:A.加入HCl酸化后,排除银离子、碳酸根离子等干扰,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42-,故A正确;
B.加入KSCN溶液,无红色出现,不含铁离子,继续加入氯水,溶液变红,可知亚铁离子被氧化为铁离子,则说明溶液中一定含有Fe2+,故B正确;
C.氨气能使湿润的红色石蕊试纸变蓝,则溶液中加入NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推测该溶液中含有NH4+,故C正确;
D.向溶液中加入盐酸,有使澄清石灰水变浑浊的无色无味的气体放出,可推测溶液中含有CO32-或HCO3-,或二者都存在,故D错误;
故选D.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象和结论为解答的关键,侧重分析与应用能力的考查,注意检验时排除干扰离子,题目难度不大.

练习册系列答案
相关题目
13.配制一定体积、一定物质的量浓度的溶液,对实验结果产生偏低影响的是( )
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 溶液未冷却至室温就转移到容量瓶中定容 | |
| C. | 定容时仰视观察液面 | |
| D. | 定容时俯视观察液面 |
11.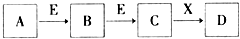 中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )
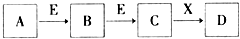 中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )| A. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| B. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| C. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
18.下列叙述不正确的是( )
| A. | CO2的摩尔质量是44 g•mol-1,表示1 mol CO2的质量为44 g | |
| B. | 硫酸溶液的物质的量浓度为1 mol•L-1,表示1 L溶液中含有1 mol硫酸 | |
| C. | 气体摩尔体积Vm≈22.4 L•mol-1,表示1 mol任何气体的体积都约为22.4 L | |
| D. | 阿伏加德罗常数NA≈6.02×1023 mol-1,表示1 mol任何粒子集体所含的粒子数约为6.02×1023 |
8.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 通常情况下,32gO2和O3的混合气体含有的分子总数小于NA | |
| B. | 常温常压下,0.1mol•L-1的硝酸铵溶液中氮原子数目为0.2NA | |
| C. | 1mol有机物 中最多有6NA个原子在一条直线上 中最多有6NA个原子在一条直线上 | |
| D. | 1mol甲基 所含的电子数为7NA 所含的电子数为7NA |
12.下列说法不正确的是( )
| A. | 增大反应物浓度,可增大单位体积内活化分子数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的化学反应,增大压强(缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂能增大单位体积内活化分子的百分数,从而成千上万倍地增大化学反应速率 |
13.金属铜的提炼多从黄铜矿(CuFeS2)开始,已知黄铜矿中铁为+2价.黄铜矿的焙烧过程中发生的主要反应为:2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是( )
| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2既是氧化剂又是还原剂 | |
| C. | O2只做氧化剂 | |
| D. | 若有1mol O2参加反应,则反应中有4mol电子转移 |
 无机物甲、乙、丙经一步反应的转化关系如图所示,其中部分反应物、生成物及反应条件已略去.
无机物甲、乙、丙经一步反应的转化关系如图所示,其中部分反应物、生成物及反应条件已略去.