题目内容
12.下列说法不正确的是( )| A. | 增大反应物浓度,可增大单位体积内活化分子数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的化学反应,增大压强(缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂能增大单位体积内活化分子的百分数,从而成千上万倍地增大化学反应速率 |
分析 增大浓度、增大压强,均使活化分子数目增多;而升高温度、使用催化剂,均使活化分子百分数增多,以此来解答.
解答 解:A.增大浓度,单位体积活化分子数目增多,则使有效碰撞次数增大,反应速率加快,故A正确;
B.有气体参加的反应,增大压强,单位体积活化分子数目增多,从而使反应速率增大,但活化分子百分数不变,故B错误;
C.升高温度,提供分子需要的能量,活化分子的百分数增大,从而使有效碰撞次数增大,则反应速率加快,故C正确;
D.催化剂,降低反应所需的活化能,增大单位体积内活化分子的百分数,故D正确.
故选B.
点评 本题考查影响反应速率的因素,为高频考点,把握浓度、温度、压强、催化剂对反应速率的影响即可解答,侧重活化理论的理解及分析的考查,题目难度不大.

练习册系列答案
相关题目
3.对溶液中的离子进行鉴定,下列实验所得结论不合理的是( )
| A. | 溶液中加入HCl酸化后,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42- | |
| B. | 溶液中加入KSCN溶液,无红色出现,继续加入氯水,溶液变红,说明溶液中一定含有Fe2+ | |
| C. | 溶液中加入NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推测该溶液中含有NH4+ | |
| D. | 向溶液中加入盐酸,有使澄清石灰水变浑浊的无色无味的气体放出,可推测溶液中含有CO32- |
20.下列各组元素中按微粒半径递增顺序排列的是( )
| A. | Li Na K | B. | Ba2+ Ca2+ Mg2+ | C. | Cl-K+ Ca2+ | D. | N O F |
7.下列各种物质中所含原子个数最多的是( )
| A. | 0.4mol氧气 | B. | 4℃时5.4mL水 | C. | 10g Ne | D. | 5.6g CO |
4.物质结构决定性质,下列叙述正确的是( )
| A. | 离子化合物熔沸点较高、共价化合物熔沸点较低 | |
| B. | 非金属原子间不可能形成离子化合物 | |
| C. | 确定某化合物为离子化合物,可以用融化时能否导电来判断 | |
| D. | 共价化合物中可能有离子键 |
1.下列盐的水溶液呈酸性的是( )
| A. | K2SO4 | B. | CaCl2 | C. | CuCl2 | D. | NaHCO3 |
2.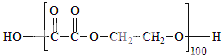 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.
无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.
(1)新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等.将5.60g α-Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为6.88g.
①产生的氢气的体积为1792mL(标准状况下).
②将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量.
(2)Nierite是一种高熔点高硬度的陶瓷材料.Nierite的摩尔质量为140g/mol,其中硅元素的质量分数为60%.已知1mol NH3与足量的化合物T充分反应后可得到35g Nierite与3mol HCl气体.Nierite的化学式为Si3N4.T的化学式为SiCl4.
(3))K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属.为测定某18K金样品的组成,将2.832g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224mL(折算至标准状况,下同),将该混合气体与84mL O2混合后缓缓通入水中,恰好被完全吸收.
①混合气体的平均摩尔质量为69g/mol.
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0).
(4)有机高分子材料聚酯纤维可由二酸与二醇通过缩聚形成.如100个乙二酸分子与100个乙二醇分子发生缩聚,当形成一条聚酯链时,其(平均)式量达到最大(如图所示,其式量为11618).
为降低聚酯链的长度与平均式量,可调整乙二酸与乙二醇的相对用量,使形成的聚酯链两端均为相同基团,从而无法再连接增长.现有100个乙二酸分子与105个乙二醇分子恰好完全反应,且聚酯链无法再增长.
①共形成5条聚酯链.
②计算所得聚酯的平均式量.
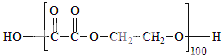 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.
无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.(1)新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等.将5.60g α-Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为6.88g.
①产生的氢气的体积为1792mL(标准状况下).
②将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量.
(2)Nierite是一种高熔点高硬度的陶瓷材料.Nierite的摩尔质量为140g/mol,其中硅元素的质量分数为60%.已知1mol NH3与足量的化合物T充分反应后可得到35g Nierite与3mol HCl气体.Nierite的化学式为Si3N4.T的化学式为SiCl4.
(3))K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属.为测定某18K金样品的组成,将2.832g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224mL(折算至标准状况,下同),将该混合气体与84mL O2混合后缓缓通入水中,恰好被完全吸收.
①混合气体的平均摩尔质量为69g/mol.
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0).
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% | 11.44% | 13.56% |
为降低聚酯链的长度与平均式量,可调整乙二酸与乙二醇的相对用量,使形成的聚酯链两端均为相同基团,从而无法再连接增长.现有100个乙二酸分子与105个乙二醇分子恰好完全反应,且聚酯链无法再增长.
①共形成5条聚酯链.
②计算所得聚酯的平均式量.
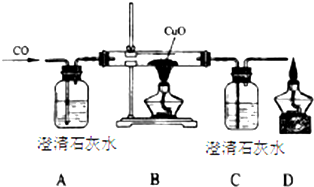 甲同学设计了如下实验装置验证一氧化碳的部分性质并验证产物.实验时,在点燃B处酒精灯之前先通入一氧化碳排出装置中的空气,然后继续实验.
甲同学设计了如下实验装置验证一氧化碳的部分性质并验证产物.实验时,在点燃B处酒精灯之前先通入一氧化碳排出装置中的空气,然后继续实验.