题目内容
14.某班同学用如下实验探究Fe2+、Fe3+的性质.回答下列问题:(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁粉,其目的是防止Fe2+被氧化
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化.FeCl2溶液与氯水反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-
(3)乙组同学取10mL0.1mol/L KI溶液,加入6mL0.1mol/L FeCl3溶液混合.分别取2mL此溶液于3 支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
②第二只试管中加入1滴KMnO4溶液,紫红色褪去;
③第三支试管中加入1滴KSCN溶液,溶液变红.
上述实验设计中不合理的是②(填序号);若在实验①中,将CCl4改为另一种试剂,颜色不同,但能起到相同的检测效果,该试剂是淀粉溶液;结合药品用量及反应,预测产生实验③现象可能的原因为该反应为可逆反应.
分析 (1)铁和氯化铁反应生成氯化亚铁,氯化亚铁溶液中加入铁粉防止氯化亚铁被氧化;
(2)氯气具有氧化性能氧化氯化亚铁为氯化铁;
(3)亚铁离子和碘离子都能使KMnO4溶液褪色;KI溶液与 FeCl3溶液反应生成单质碘,用淀粉溶液检验生成的单质碘;在I-过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应.
解答 解:(1)铁和氯化铁反应生成氯化亚铁,在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化,
故答案为:防止Fe2+被氧化;
(2)氯气具有氧化性能氧化氯化亚铁为氯化铁,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-,
故答案为:Cl2+2Fe2+=2Fe3++2Cl-;
(3)亚铁离子和碘离子都能使KMnO4溶液褪色,所以不能用高锰酸钾溶液检验是否含有亚铁离子;KI溶液与 FeCl3溶液反应生成单质碘,用淀粉溶液检验生成的单质碘;第三支试管中加入1滴KSCN溶液,溶液变红,说明随浓度变小,碘离子在稀的氯化铁溶液中不发生氧化还原反应,仍含有铁离子,在I-过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应.
故答案为:②;淀粉溶液;该反应为可逆反应.
点评 本题考查了铁及化合物的性质、氧化还原反应、离子方程式书写、离子检验等知识点,注意题干信息的分析判断,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
4.下列反应的离子方程式错误的是( )
| A. | 稀硝酸和过量铁屑反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 氯化铝溶液和过量的氨水反应:Al3++4NH3•H2O═Al2-+4NH4++2H2O | |
| C. | 碳酸钠溶液中加入过量苯酚: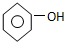 +CO32-→ +CO32-→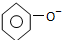 +HCO3- +HCO3- | |
| D. | 次氯酸钙溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- |
5.用铁片与稀硫酸制取氢气时,下列措施不能使制取氢气的反应速率加快的是( )
| A. | 加热 | B. | 向溶液中加一定量的Cu(NO3)2固体 | ||
| C. | 改用含较多杂质的铁片 | D. | 向溶液中加一定量的CuSO4固体 |
9.下列操作可得纯净Al2O3的是( )
| A. | 向NaAlO2溶液中加入适量的稀硫酸后,蒸干并灼烧 | |
| B. | 向NaAlO2溶液中通入过量的CO2后,过滤并灼烧 | |
| C. | 向AlCl3溶液中加入适量的NaAlO2溶液后,蒸干并灼烧 | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液后,过滤并灼烧 |
19. 金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )
金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )
 金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )
金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )| A. | 绿原酸能与FeCl3发生显色反应 | |
| B. | 1个绿原酸分子中含有4个手性碳原子 | |
| C. | 绿原酸与足量的NaOH反应,其中一种产物的化学式为C9H5O4Na3 | |
| D. | 1mol绿原酸最多能与6molH2发生反应 |
6.下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合中,正确的是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 冰醋酸 | 汽油 | 苛性钾 | 碳酸氢钠 | 乙醇 |
| C | 烧碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 胆矾 | 石灰水 | 硫酸钡 | H2O | NH3 |
| A. | A | B. | B | C. | C | D. | D |
3.对溶液中的离子进行鉴定,下列实验所得结论不合理的是( )
| A. | 溶液中加入HCl酸化后,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42- | |
| B. | 溶液中加入KSCN溶液,无红色出现,继续加入氯水,溶液变红,说明溶液中一定含有Fe2+ | |
| C. | 溶液中加入NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推测该溶液中含有NH4+ | |
| D. | 向溶液中加入盐酸,有使澄清石灰水变浑浊的无色无味的气体放出,可推测溶液中含有CO32- |
4.物质结构决定性质,下列叙述正确的是( )
| A. | 离子化合物熔沸点较高、共价化合物熔沸点较低 | |
| B. | 非金属原子间不可能形成离子化合物 | |
| C. | 确定某化合物为离子化合物,可以用融化时能否导电来判断 | |
| D. | 共价化合物中可能有离子键 |