题目内容
18.下列说法错误的是( )| A. | 分子的稳定性与分子间作用力的大小无关 | |
| B. | BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 | |
| C. | NH4+和CH4属于等电子体,立体构型都是正四面体 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
分析 A.分子的稳定性与分子内的化学键有关;
B.共价化合物分子中元素原子最外层电子数+|该元素化合价|(或共价键数目)=8,该元素原子满足8电子结构;分子中若含有氢元素,则氢原子不能满足最外层8电子稳定结构;
C.等电子体的结构相似;
D.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键.
解答 解:A.分子的稳定性与分子内的化学键强弱有关,分子间作用力是确定物质聚集状态,所以分子的稳定性与分子间作用力的大小无关,故A正确;
B.BF3分子中B原子不满足8电子结构,H2O分子中H原子不满足8电子结构,NCl3中所有原子都满足最外层为8电子结构,故B正确;
C.NH4+和CH4的原子数、价电子数都相等,属于等电子体,中心原子的价层电子对数均为4,因此空间构型都是正四面体,故C正确;
D.在[Cu(NH3)4]2+离子中,铜离子含有空轨道,氨气分子含有孤电子对,所以Cu2+提供空轨道,NH3给出孤电子对,故D错误;
故选D.
点评 本题考查了分子的稳定性、分子间作用力、8电子结构、等电子体、配合物的成键情况等,题目涉及的知识点较多,明确配位键的形成条件,题目难度中等.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
8.下列对沉淀溶解平衡的描述正确的是( )
| A. | BaSO4属于难溶物,它在水中完全不能溶解 | |
| B. | 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 | |
| C. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 | |
| D. | 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
9.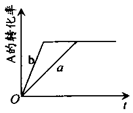 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )| A. | 增大A的浓度或减少C的浓度 | B. | 缩小容器的容积或加入催化剂 | ||
| C. | 升高温度或增大压强 | D. | 移走部分D |
6.水体污染加剧水资源短缺,严重危害人体健康.下列关于水污染的描述中不正确的是( )
| A. | 水俣病是由汞等重金属污染水体而造成的 | |
| B. | “赤潮”和“水华”是由水体富营养化而形成的 | |
| C. | 海湾战争期间波斯湾严重的石油泄漏事件是人类历史上一次灾难性的水体污染事件 | |
| D. | 化肥和农药的广泛使用可以促进农产品增产,不会造成水体污染 |
13.下列各组在溶液中的反应,无论谁过量,都可以用同一离子方程式表示的是( )
| A. | Ba(OH)2与NaHSO4 | B. | Ba(OH)2与H2SO4 | ||
| C. | 石灰水和二氧化碳 | D. | Ca(HCO3)2与NaOH |
3.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述中不正确的是( )
| A. | Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间 | |
| B. | 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 | |
| C. | 往FeCl3溶液中加入NaOH溶液,并适当加热,可制得Fe(OH)3胶体 | |
| D. | 三种分散系中分散质均属于电解质 |
4. 某学生探究AgCl、Ag2S沉淀转化的原因.
某学生探究AgCl、Ag2S沉淀转化的原因.
(1)Ⅰ中的白色沉淀是AgCl.
(2)Ⅱ中能说明沉淀变黑的离子方程式是2AgCl(s)+S2-?Ag2S(s)+2Cl-,沉淀转化的主要原因是Ag2S比AgCl溶解度更小.
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl.用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y.
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是SO42-.
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀S.
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化.
①A中产生的气体是O2.
②C中盛放的物质W是Ag2S的悬浊液.
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S+1O2++4NaCl+2H2O?4AgCl+2S+4NaOH.
 某学生探究AgCl、Ag2S沉淀转化的原因.
某学生探究AgCl、Ag2S沉淀转化的原因.| 步 骤 | 现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 较长时间后,沉淀变为乳白色 |
(2)Ⅱ中能说明沉淀变黑的离子方程式是2AgCl(s)+S2-?Ag2S(s)+2Cl-,沉淀转化的主要原因是Ag2S比AgCl溶解度更小.
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl.用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y.
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是SO42-.
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀S.
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化.
| 现象 | B.一段时间后,出现白色沉淀 |
| C.一点时间后,无明显变化 |
②C中盛放的物质W是Ag2S的悬浊液.
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S+1O2++4NaCl+2H2O?4AgCl+2S+4NaOH.
5.在固定容积的容器中,某化学反应2A(g)?B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度( mol/L )随反应时间( min )的变化情况见表.
根据上述数据,完成下列填空:
(1)在实验1中,反应在10min至20min时间内平均速率v(A)为0.013mol/(L•min);达到平衡时A的转化率是50%,B的浓度是0.25mol/L;800℃时,该反应2A(g)?B(g)+D(g) 的平衡常数数值是0.25;若同温下,另一个恒容密闭的容器中也在发生该反应,某时刻A、B、D的浓度均为2mol/L,则该时刻v(正)<v(逆)(填“>”“=”或“<”).
(2)在实验2中,A的初始浓度c1=1.0mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是使用了催化剂.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3<v1(填“>”“=”或“<”),且c2> 1.0mol/L (填“>”“=”或“<”).
(4)比较实验4和实验1,可推测该反应是放热反应(填“吸热”或“放热”).
| 实验序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 820℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 820℃ | c1 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 800℃ | 1.0 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1中,反应在10min至20min时间内平均速率v(A)为0.013mol/(L•min);达到平衡时A的转化率是50%,B的浓度是0.25mol/L;800℃时,该反应2A(g)?B(g)+D(g) 的平衡常数数值是0.25;若同温下,另一个恒容密闭的容器中也在发生该反应,某时刻A、B、D的浓度均为2mol/L,则该时刻v(正)<v(逆)(填“>”“=”或“<”).
(2)在实验2中,A的初始浓度c1=1.0mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是使用了催化剂.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3<v1(填“>”“=”或“<”),且c2> 1.0mol/L (填“>”“=”或“<”).
(4)比较实验4和实验1,可推测该反应是放热反应(填“吸热”或“放热”).
