题目内容
17.根据如图所示实验装置,回答下列问题: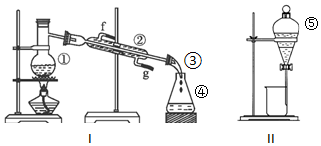
(1)写出下列仪器的名称:①蒸馏烧瓶,②冷凝管,④锥形瓶,⑤分液漏斗.
(2)若利用装置I分离酒精和水的混合物,还缺少的仪器是温度计;在实验中,仪器①中加入沸石的作用是防暴沸;②的进水口是g (填“f”或“g”).
(3)使用装置II进行的实验操作名称为分液,实验前需进行的操作为检验装置气密性.
(4)若在实验室中进行石油的分离实验制取汽油,应选择的实验装置是I(填“I”或“II”).
分析 (1)①②④⑤分别是蒸馏烧瓶、冷凝管、锥形瓶、分液漏斗;
(2)蒸馏时需要控制温度;沸石有防暴沸的作用;冷凝管中的水流采用逆流方式;
(3)分离互不相溶的液体采用分液方法,含有活塞的仪器在使用前必须检查装置的气密性;
(4)互溶的液体采用蒸馏方法分离提纯.
解答 解:(1)根据仪器图象知,)①②④⑤分别是蒸馏烧瓶、冷凝管、锥形瓶、分液漏斗,
故答案为:①蒸馏烧瓶(圆底烧瓶);②冷凝器;④锥形瓶;⑤分液漏斗;
(2)蒸馏时需要控制温度,所以还需要测量温度的温度计;沸石有防暴沸的作用,防止液体剧烈沸腾而产生安全事故;冷凝管中的水流采用逆流方式,所以g是进水口、h是出水口,
故答案为:温度计;防暴沸;g;
(3)该操作是分液,适用于分离互不相溶的液体,含有活塞的仪器在使用前必须检查装置的气密性,分液漏斗中含有活塞,为防止实验失败,在使用前必须检验气密性,
故答案为:分液;检验装置的气密性;
(4)石油中各成分互溶且是液体,应该采用蒸馏的方法,故选I.
点评 本题考查物质分离提纯实验方案设计,为高频考点,涉及仪器选取、物质分离提纯等知识点,明确物质性质差异性是解本题关键,会根据物质性质选取合适的分离提纯方法,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.在当今社会,氮的氢化物和氧化物与我们的生活息息相关.
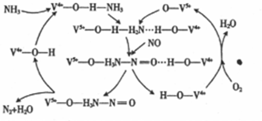
(1)NO是一种污染物,工业上用NH3、O2脱除烟气中NO的原理如图所示,该原理中NO最终转化为N2(填化学式),V4+-O-H在反应过程中作催化剂.当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为44.8L.
(2)N2H4是发射航天火箭的常用燃料,已知:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-538kJ•mol-1.断开1mol下列化学键系数的能量分别为N-H:390kJ、N≡N:946kJ、O-H:460kJ、O=O:498kJ.则断开1molN-N需要吸收的能量是190kJ.
(3)工业制硝酸时,会发生反应:4NH3(g)+5O2(g)$?_{加热}^{催化剂}$4NO(g)+6H2O(g)△H<0.
①若其它条件不变,则下列图象不正确的是D(填字母).

②在1L容积固定的密闭容器中充入NH3和O2发生该反应,部分物质的浓度随时间的变化如下表所示.
0~4min内,用O2表示该反应的平均反应速率为0.25mol•L-1•min-1.反应6~8min时改变了反应条件,改变的反应条件可能是升高温度.
(1)NO是一种污染物,工业上用NH3、O2脱除烟气中NO的原理如图所示,该原理中NO最终转化为N2(填化学式),V4+-O-H在反应过程中作催化剂.当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为44.8L.

(2)N2H4是发射航天火箭的常用燃料,已知:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-538kJ•mol-1.断开1mol下列化学键系数的能量分别为N-H:390kJ、N≡N:946kJ、O-H:460kJ、O=O:498kJ.则断开1molN-N需要吸收的能量是190kJ.
(3)工业制硝酸时,会发生反应:4NH3(g)+5O2(g)$?_{加热}^{催化剂}$4NO(g)+6H2O(g)△H<0.
①若其它条件不变,则下列图象不正确的是D(填字母).

②在1L容积固定的密闭容器中充入NH3和O2发生该反应,部分物质的浓度随时间的变化如下表所示.
 | c(NH3)/mol•L-1 | c(O2)/mol•L-1 | c(NO)mol•L-1 |
| 0 | 1.2 | 1.75 | 0 |
| 4min | 0.4 | 0.75 | 0.8 |
| 6min | 0.4 | 0.75 | 0.8 |
| 8min | 0.6 | 1 | 0.6 |
| 9min | 0.6 | 1 | 0.6 |
| 10min | 1.05 | 1 | 1.05 |
| 12min | … | … | … |
8.下列对沉淀溶解平衡的描述正确的是( )
| A. | BaSO4属于难溶物,它在水中完全不能溶解 | |
| B. | 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 | |
| C. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 | |
| D. | 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
12.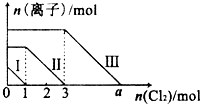 向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )
 向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )| A. | 线段Ⅲ代表Fe2+的变化情况 | B. | 原混合溶液中n(FeBr2)=4mol | ||
| C. | 线段Ⅰ代表Br-的变化情况 | D. | a值等于6 |
2.下列实验操作中错误的是( )
| A. | 过滤时,玻璃棒的末端应轻轻靠在三层滤纸上 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 称氢氧化钠时,不能直接称量,要放在纸片上称量 |
9.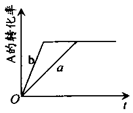 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )| A. | 增大A的浓度或减少C的浓度 | B. | 缩小容器的容积或加入催化剂 | ||
| C. | 升高温度或增大压强 | D. | 移走部分D |
6.水体污染加剧水资源短缺,严重危害人体健康.下列关于水污染的描述中不正确的是( )
| A. | 水俣病是由汞等重金属污染水体而造成的 | |
| B. | “赤潮”和“水华”是由水体富营养化而形成的 | |
| C. | 海湾战争期间波斯湾严重的石油泄漏事件是人类历史上一次灾难性的水体污染事件 | |
| D. | 化肥和农药的广泛使用可以促进农产品增产,不会造成水体污染 |
4. 某学生探究AgCl、Ag2S沉淀转化的原因.
某学生探究AgCl、Ag2S沉淀转化的原因.
(1)Ⅰ中的白色沉淀是AgCl.
(2)Ⅱ中能说明沉淀变黑的离子方程式是2AgCl(s)+S2-?Ag2S(s)+2Cl-,沉淀转化的主要原因是Ag2S比AgCl溶解度更小.
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl.用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y.
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是SO42-.
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀S.
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化.
①A中产生的气体是O2.
②C中盛放的物质W是Ag2S的悬浊液.
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S+1O2++4NaCl+2H2O?4AgCl+2S+4NaOH.
 某学生探究AgCl、Ag2S沉淀转化的原因.
某学生探究AgCl、Ag2S沉淀转化的原因.| 步 骤 | 现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 较长时间后,沉淀变为乳白色 |
(2)Ⅱ中能说明沉淀变黑的离子方程式是2AgCl(s)+S2-?Ag2S(s)+2Cl-,沉淀转化的主要原因是Ag2S比AgCl溶解度更小.
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl.用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y.
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是SO42-.
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀S.
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化.
| 现象 | B.一段时间后,出现白色沉淀 |
| C.一点时间后,无明显变化 |
②C中盛放的物质W是Ag2S的悬浊液.
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S+1O2++4NaCl+2H2O?4AgCl+2S+4NaOH.
