题目内容
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),
其化学平衡常数K和温度T的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K= .
(2)该反应为 反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)830℃下,若物质的浓度关系是c(CO2)?c(H2)>c(CO)?c(H2O),则此时正反应速率与逆反应速率的关系是 .
a.υ正>υ逆 b.υ正=υ逆 c.υ正<υ逆 d.无法判断.
其化学平衡常数K和温度T的关系如下表:
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)830℃下,若物质的浓度关系是c(CO2)?c(H2)>c(CO)?c(H2O),则此时正反应速率与逆反应速率的关系是
a.υ正>υ逆 b.υ正=υ逆 c.υ正<υ逆 d.无法判断.
考点:化学平衡状态的判断,化学平衡常数的含义
专题:化学平衡专题
分析:(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)图表分析平衡常数随温度升高增大,说明平衡正向进行,正反应为吸热反应;
(3)化学平衡状态的标志:正逆反应速率相等;
(4)830℃下,若物质的浓度关系是c(CO2)?c(H2)>c(CO)?c(H2O),依据平衡常数分析判断分析进行的方向.
(2)图表分析平衡常数随温度升高增大,说明平衡正向进行,正反应为吸热反应;
(3)化学平衡状态的标志:正逆反应速率相等;
(4)830℃下,若物质的浓度关系是c(CO2)?c(H2)>c(CO)?c(H2O),依据平衡常数分析判断分析进行的方向.
解答:
解:(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=
,故答案为:
;
(2)图表分析平衡常数随温度升高增大,说明平衡正向进行,正反应为吸热反应;
故答案为:吸热;
(3)CO2(g)+H2(g)?CO(g)+H2O(g),反应是气体体积不变的吸热反应,
a、反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故a错误;
b、化学平衡时,各组分的浓度不随时间的改变而改变,故b正确;
c、化学平衡状态的标志是v正=v逆,所以v正(H2)=v正(H2O)表明反应达到平衡状态,故c正确;
d、c(CO2)=c(CO)时,取决起始浓度和转化率,不能判断达到了平衡状态,故d错误.
故选bc;
(4)830℃下,K=1,若物质的浓度关系是c(CO2)?c(H2)>c(CO)?c(H2O),说明Q=
<K=1,反应正向进行,υ正>υ逆;
故答案为:a.
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
(2)图表分析平衡常数随温度升高增大,说明平衡正向进行,正反应为吸热反应;
故答案为:吸热;
(3)CO2(g)+H2(g)?CO(g)+H2O(g),反应是气体体积不变的吸热反应,
a、反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故a错误;
b、化学平衡时,各组分的浓度不随时间的改变而改变,故b正确;
c、化学平衡状态的标志是v正=v逆,所以v正(H2)=v正(H2O)表明反应达到平衡状态,故c正确;
d、c(CO2)=c(CO)时,取决起始浓度和转化率,不能判断达到了平衡状态,故d错误.
故选bc;
(4)830℃下,K=1,若物质的浓度关系是c(CO2)?c(H2)>c(CO)?c(H2O),说明Q=
| c(CO)c(H2O) |
| c(CO2)c(H2) |
故答案为:a.
点评:本题考查化学平衡状态的判断,化学平衡常数的计算等知识,难度中等,注意平衡常数只与温度有关.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1L 1.0mol/L Na2SO4溶液中离子的总数为2NA |
| B、在标准状况下,NA个CCl4分子所占的体积为22.4L |
| C、0.5mol Mg2+的最外电子总数4NA |
| D、常温常压下,11.2L氨气含有的质量为8.5g |
为了鉴别某白色纺织品成分是蚕丝还是人造丝,可选用的方法是( )
| A、滴加浓烧碱 | B、滴加浓盐酸 |
| C、滴加酒精 | D、灼烧 |
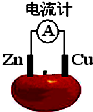 理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池. 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答: