题目内容
将足量铁粉溶于200mL盐酸中,标准状况下,生成5.6L的H2(溶液体积变化忽略不计).求:
(1)消耗铁的物质的量.
(2)盐酸的物质的量浓度.
(1)消耗铁的物质的量.
(2)盐酸的物质的量浓度.
考点:化学方程式的有关计算
专题:计算题
分析:铁和稀盐酸反应生成氯化亚铁和氢气,反应方程式为Fe+2HCl=FeCl2+H2↑,
(1)根据铁和氢气之间的关系式计算铁的物质的量;
(2)根据氢原子守恒计算盐酸的物质的量浓度.
(1)根据铁和氢气之间的关系式计算铁的物质的量;
(2)根据氢原子守恒计算盐酸的物质的量浓度.
解答:
解:铁和稀盐酸反应生成氯化亚铁和氢气,反应方程式为Fe+2HCl=FeCl2+H2↑,
(1)设消耗铁的物质的量为x,
Fe+2HCl=FeCl2+H2↑,
1molg 22.4L
x 5.6L
1mol:22.4L=x:5.6L
x=
=0.25mol,
答:消耗铁的物质的量为0.25mol;
(2)根据氢原子守恒得n(HCl)=2n(H2)=2×
=0.5mol,c(HCl)=
=2.5mol/L,
答:盐酸的物质的量浓度为2.5mol/L.
(1)设消耗铁的物质的量为x,
Fe+2HCl=FeCl2+H2↑,
1molg 22.4L
x 5.6L
1mol:22.4L=x:5.6L
x=
| 1mol×5.6L |
| 22.4L |
答:消耗铁的物质的量为0.25mol;
(2)根据氢原子守恒得n(HCl)=2n(H2)=2×
| 5.6L |
| 22.4L/mol |
| 0.5mol |
| 0.2L |
答:盐酸的物质的量浓度为2.5mol/L.
点评:本题考查了根据方程式的计算,明确氢气与铁、盐酸之间的关系式即可解答,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
将下列各组物质按酸、碱、盐分类顺次排列.其中正确的是( )
| A、硫酸,纯碱,醋酸钠 |
| B、硝酸,烧碱,纯碱 |
| C、盐酸,乙醇,醋酸钠 |
| D、盐酸,熟石灰,苛性钠 |
下列说法中正确的是( )
| A、分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种 |
| B、丙烯能发生加成反应,还能使酸性KMnO4溶液褪色,但不能发生取代反应 |
| C、乙烷和丙烯的物质的量共1mol,完成燃烧生成3mol H2O |
| D、相同质量的甲烷和乙烷完全燃烧乙烷耗氧量多 |
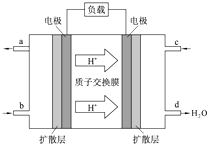 人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题: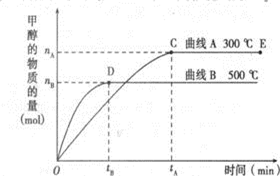 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):