题目内容
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
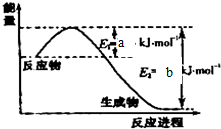
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:(1)如图是1molN2和3molH2反应生成2molNH3过程中能量变化示意图,该反应为
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g),其化学平衡常数K与温度t 的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1
②判断该反应达到化学平衡状态的依据是
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)NH4Cl水溶液呈酸性,其原因是(用离子方程式表示)
(4)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2mol N2、8mol H2及固体催化剂.10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为
(5)在上述相同条件下,若起始时加入4mol NH3、2mol H2及固体催化剂,反应达到平衡时 NH3的体积分数比(3)中
考点:化学平衡常数的含义,反应热和焓变,化学平衡状态的判断,化学平衡的计算,盐类水解的应用,离子浓度大小的比较
专题:化学反应中的能量变化,化学平衡专题,盐类的水解专题
分析:(1)反应物总能量大于生成物总能量,则反应是放热反应;活化能=E1-E2;
(2)①该反应的正反应是放热反应,升高温度,平衡向逆反应方向移动,化学平衡常数减小;
②当反应前后改变的物理量不变时,该反应达到平衡状态;
(3)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈碱性,氯离子不水解,铵根离子水解程度较小,据此确定溶液中离子浓度大小;
(4)同一温度下,同一容器中,气体的物质的量之比等于其压强之比,则平衡状态混合气体的物质的量=(2+8)mol×80%=8mol,反应中减少的物质的量等于氨气的物质的量,所以n(NH3)=(2+8)mol×(1-80%)=2mol,据此计算氨气的体积分数;
根据v=
计算氮气反应速率;
N2(g)+3H2(g)?2NH3(g)△H<0,要提高氨气产率,则平衡向正反应方向移动,可以通过改变温度、压强、气体的浓度来实现;
(5)将氨气完全转化为氮气和氢气,则氮气和氢气的物质的量分别与(3)中氮气、氢气的物质的量相等,所以两个体系是等效平衡,平衡时两个容器中氨气的体积分数相等.
(2)①该反应的正反应是放热反应,升高温度,平衡向逆反应方向移动,化学平衡常数减小;
②当反应前后改变的物理量不变时,该反应达到平衡状态;
(3)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈碱性,氯离子不水解,铵根离子水解程度较小,据此确定溶液中离子浓度大小;
(4)同一温度下,同一容器中,气体的物质的量之比等于其压强之比,则平衡状态混合气体的物质的量=(2+8)mol×80%=8mol,反应中减少的物质的量等于氨气的物质的量,所以n(NH3)=(2+8)mol×(1-80%)=2mol,据此计算氨气的体积分数;
根据v=
| ||
| △t |
N2(g)+3H2(g)?2NH3(g)△H<0,要提高氨气产率,则平衡向正反应方向移动,可以通过改变温度、压强、气体的浓度来实现;
(5)将氨气完全转化为氮气和氢气,则氮气和氢气的物质的量分别与(3)中氮气、氢气的物质的量相等,所以两个体系是等效平衡,平衡时两个容器中氨气的体积分数相等.
解答:
解:(1)根据图象知,反应物总能量大于生成物总能量,所以该反应是放热反应,其活化能═E1-E2=bkJ/mol-akJ/mol=(b-a)kJ/mol,
故答案为:放热反应;b-a;
(2)①该反应是放热反应,升高温度,平衡向逆反应方向移动,则其平衡常数减小,所以K1>K2,故答案为:>;
②A.2v(H2)(正)=3v(NH3)(逆)时,氢气的正逆反应速率相等,则该反应达到平衡状态,故正确;
B.3v(N2)(正)=v(H2)(逆)时该反应达到平衡状态,当2v(N2)(正)=v(H2)(逆)时该反应未达到平衡状态,故错误;
C.容器内压强保持不变时,平衡体系中各物质的含量不变,则该反应达到平衡状态,故正确;
D.无论该反应是否达到平衡状态,混合气体的密度始终保持不变,所以不能据此判断平衡状态,故错误;
故选AC;
(3)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,水解方程式为NH4++H2O?NH3?H2O+H+,钠离子不水解,铵根离子水解程度较小,所以该溶液中离子浓度大小顺序是C(Cl-)>C(NH4+)>C(H+)>C(OH-),故答案为:NH4++H2O?NH3?H2O+H+;C(Cl-)>C(NH4+)>C(H+)>C(OH-);
(4)同一温度下,同一容器中,气体的物质的量之比等于其压强之比,则平衡状态混合气体的物质的量=(2+8)mol×80%=8mol,反应中减少的物质的量等于氨气的物质的量,所以n(NH3)=(2+8)mol×(1-80%)=2mol,氨气的体积分数=氨气的物质的量分数=
×100%=25%;
参加反应的n(N2)=
n(NH3)=
×2mol=1mol,
氮气的反应速率v=
=
=0.01mol/(L.min);
N2(g)+3H2(g)?2NH3(g)△H<0,该反应是反应前后气体体积减小、放热的可逆反应,要提供氨气产率,则平衡向正反应方向移动,可以通过降低温度、增大压强、增大氢气或氮气浓度、减小氨气浓度来实现,
故答案为:25%;0.01mol/(L?min);增大氢气浓度、增大氮气浓度、降温、增大压强或及时转移走生成的氨;
(5)将氨气完全转化为氮气和氢气,氮气的物质的量为2mol、氢气的物质的量为8mol,则氮气和氢气的物质的量分别与(3)中氮气、氢气的物质的量相等,所以两个体系是等效平衡,平衡时两个容器中氨气的体积分数相等相等,故答案为:相等.
故答案为:放热反应;b-a;
(2)①该反应是放热反应,升高温度,平衡向逆反应方向移动,则其平衡常数减小,所以K1>K2,故答案为:>;
②A.2v(H2)(正)=3v(NH3)(逆)时,氢气的正逆反应速率相等,则该反应达到平衡状态,故正确;
B.3v(N2)(正)=v(H2)(逆)时该反应达到平衡状态,当2v(N2)(正)=v(H2)(逆)时该反应未达到平衡状态,故错误;
C.容器内压强保持不变时,平衡体系中各物质的含量不变,则该反应达到平衡状态,故正确;
D.无论该反应是否达到平衡状态,混合气体的密度始终保持不变,所以不能据此判断平衡状态,故错误;
故选AC;
(3)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,水解方程式为NH4++H2O?NH3?H2O+H+,钠离子不水解,铵根离子水解程度较小,所以该溶液中离子浓度大小顺序是C(Cl-)>C(NH4+)>C(H+)>C(OH-),故答案为:NH4++H2O?NH3?H2O+H+;C(Cl-)>C(NH4+)>C(H+)>C(OH-);
(4)同一温度下,同一容器中,气体的物质的量之比等于其压强之比,则平衡状态混合气体的物质的量=(2+8)mol×80%=8mol,反应中减少的物质的量等于氨气的物质的量,所以n(NH3)=(2+8)mol×(1-80%)=2mol,氨气的体积分数=氨气的物质的量分数=
| 2mol |
| 8mol |
参加反应的n(N2)=
| 1 |
| 2 |
| 1 |
| 2 |
氮气的反应速率v=
| ||
| △t |
| ||
| 10min |
N2(g)+3H2(g)?2NH3(g)△H<0,该反应是反应前后气体体积减小、放热的可逆反应,要提供氨气产率,则平衡向正反应方向移动,可以通过降低温度、增大压强、增大氢气或氮气浓度、减小氨气浓度来实现,
故答案为:25%;0.01mol/(L?min);增大氢气浓度、增大氮气浓度、降温、增大压强或及时转移走生成的氨;
(5)将氨气完全转化为氮气和氢气,氮气的物质的量为2mol、氢气的物质的量为8mol,则氮气和氢气的物质的量分别与(3)中氮气、氢气的物质的量相等,所以两个体系是等效平衡,平衡时两个容器中氨气的体积分数相等相等,故答案为:相等.
点评:本题考查了化学平衡的有关知识,涉及离子浓度大小比较、等效平衡、化学平衡移动、反应速率计算等知识点,根据物质的性质、反应特点、等效平衡特点等知识点来分析解答,这些知识点都是考试热点,熟练掌握基础知识,题目难度中等.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
 某反应的反应过程中能量变化如图所示.下列有关叙述不正确的是( )
某反应的反应过程中能量变化如图所示.下列有关叙述不正确的是( )| A、该反应的△H>0 |
| B、E1表示正反应的活化能 |
| C、E2表示逆反应的活化能 |
| D、使用催化剂降低正反应的活化能,不能降低逆反应的活化能 |
150℃、1个大气压下,使等物质的量的下列物质完全分解,生成气体的体积最大的是( )
| A、HNO3 |
| B、NH4I |
| C、NaHCO3 |
| D、KMnO4 |