题目内容
9.常温下,0.1mol•L-1NaHB溶液中存在的离子有:Na+、B2-、HB-、H+、OH-,存在的分子只有H2O;且c(H+)=0.01mol•L-1,根据题意回答下列问题:①该溶液中c(HB-)+c(B2-)=0.1mol•L-1
②写出酸H2B的电离方程式H2B=H++HB-﹑HB-?H++B2-.
③常温下,0.1mol•L-1H2B溶液c(H+)<0.11mol•L-1(填>、<或=).
分析 ①溶液不存在H2B,根据物料守恒分析;
②由于溶液不存在H2B,说明H2B的第一步电离是完全电离,第二步二元弱酸;
③第一步电离中H+对第二步的电离产生了抑制.
解答 解:①溶液不存在H2B,由物料守恒可知,0.1mol•L-1NaHB溶液中c(HB-)+c(B2-)=0.1mol/L;
故答案为:0.1;
②由于溶液不存在H2B,说明H2B的第一步电离是完全电离,第二步二元弱酸,则电离方程式为:H2B=H++HB-﹑HB-?H++B2-;
故答案为:H2B=H++HB-﹑HB-?H++B2-;
③由于溶液中只存在的分子为H2O,说明H2B为中强酸,电离方程式为H2B=H++HB-﹑HB-?H++B2-;由物料守恒可知c(HB-)+c(B2-)=c(Na+)=0.1mol/L;0.1mol•L-1NaHB溶液c(H+)=0.01mol•L-1,则有HB-的电离度是10%,H2B的第一步电离为完全电离,第二步为部分电离,且第一步电离中H+对第二步的电离产生了抑制,故H2B溶液c(H+)<0.11mol•L-1;
故答案为:<.
点评 本题考查学生弱电解质的电离平衡,题目难度中等,注意根据溶液中存在的离子判断电离程度,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
19.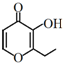 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | lmol该有机物最多能与2molH2发生加成反应 | |
| B. | 该有机物的分子式为C7H8O3 | |
| C. | 该有机物能发生取代反应、加成反应、消去反应和氧化反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
20.工业利用冶铜炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制Fe2O3的生产流程示意图如下:
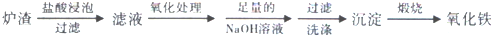
经“足量的NaOH溶液”处理后,铝元素的存在形态为( )
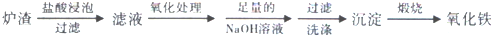
经“足量的NaOH溶液”处理后,铝元素的存在形态为( )
| A. | Al | B. | Al(OH)3 | C. | Al3+ | D. | [Al(OH)4]- |
17.某有机物的结构简式为HO-CH2CH=CHCH2-COOH.下列说法不正确的是( )
| A. | 它能与Na、NaOH、NaHC03等物质反应 | B. | 它能发生酯化、氧化、加成等反应 | ||
| C. | 该有机物分子式为C5H8O3 | D. | 它是乙酸也是乙醇的同系物 |
4.下列关于铁的叙述正确的是( )
①铁能被磁铁吸引,但纯铁易锈蚀
②在人体的血红蛋白中含有铁元素
③不能通过化合反应生成FeCl2和Fe(OH)3
④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧
⑤铁与硝酸反应的产物仅是Fe(NO3)3.
①铁能被磁铁吸引,但纯铁易锈蚀
②在人体的血红蛋白中含有铁元素
③不能通过化合反应生成FeCl2和Fe(OH)3
④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧
⑤铁与硝酸反应的产物仅是Fe(NO3)3.
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ③⑤ |
14.常温下,下列各组离子在指定的溶液中可能大量共存的是( )
| A. | 无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- | |
| B. | 含大量Fe3+的溶液中:K+、I-、SO42-、NO3- | |
| C. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- | |
| D. | 由水电离出的c(H+)=1.0×10-14mol/L的溶液中:Mg2+、K+、Cl-、SO42- |
1.在下列4种化合物:①NaHCO3 ②Al2O3 ③(NH4)2S ④CH3COONH4中,跟盐酸和氢氧化钠溶液都能反应的是( )
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
18.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y的轨道表示式为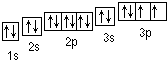 ;
;
(2)X、Y、Z三种元素的原子半径从大到小的顺序是S>Cl>C(用元素符号表示);
(3)XY2的分子中存在2个σ键,分子的空间构形为直线形,在H-Y、H-Z两种共价键中,键长较长的是H-S;
(4)W3+的核外电子排布式是1s22s22p63s23p63d5;
(5)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.此反应的化学方程式是2CO+SO2=S+2CO2;
(6)请设计一个实验方案,比较Y、Z单质氧化性的强弱在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为56,中子数为30 |
 ;
;(2)X、Y、Z三种元素的原子半径从大到小的顺序是S>Cl>C(用元素符号表示);
(3)XY2的分子中存在2个σ键,分子的空间构形为直线形,在H-Y、H-Z两种共价键中,键长较长的是H-S;
(4)W3+的核外电子排布式是1s22s22p63s23p63d5;
(5)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.此反应的化学方程式是2CO+SO2=S+2CO2;
(6)请设计一个实验方案,比较Y、Z单质氧化性的强弱在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
9.化学使人类生活得更美好的一门自然科学.下列说法正确的是( )
| A. | 豆浆富含蛋白质,煮沸后蛋白质变成了氨基酸 | |
| B. | 浓硫酸可刻蚀石英制艺术品 | |
| C. | 氢氧化铝可作胃酸的中和剂 | |
| D. | 装饰材料中释放的甲醛、苯不会造成污染 |