题目内容
17.某有机物的结构简式为HO-CH2CH=CHCH2-COOH.下列说法不正确的是( )| A. | 它能与Na、NaOH、NaHC03等物质反应 | B. | 它能发生酯化、氧化、加成等反应 | ||
| C. | 该有机物分子式为C5H8O3 | D. | 它是乙酸也是乙醇的同系物 |
分析 该物质中含有醇羟基、碳碳双键和羧基,具有醇、烯烃和羧酸性质,能发生取代反应、加成反应、加聚反应和氧化反应,据此分析解答.
解答 解:A.醇羟基和羧基能与Na反应,-COOH能和NaOH、NaHC03反应,故A正确;
B.羧基和醇羟基都能发生酯化反应,醇羟基和碳碳双键能发生氧化反应,碳碳双键能发生加成反应,故B正确;
C.根据结构简式知,其分子式为C5H8O3,故C正确;
D.该物质中醇羟基和羧基,其结构和乙酸、乙醇都不相似,所以既不是乙酸同系物也不是乙醇同系物,故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查醇、烯烃和羧酸性质,知道同系物概念内涵,题目难度不大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
7.不能用来鉴别Na2CO3与NaHCO3两种白色固体的实验操作是( )
| A. | 分别加热,观察有无气体生成 | |
| B. | 制成稀溶液,再分别滴加同浓度的稀盐酸 | |
| C. | 制成稀溶液,分别加入CaCl2溶液 | |
| D. | 制成溶液,分别加入少量澄清的石灰水 |
8.四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,Y、W同主族且能形成两种常见的化合物,X、W质子数之和是Z质子数的2倍.则下列说法中正确的是( )
| A. | 原子半径比较:X<Y<Z<W | |
| B. | Y的氢化物沸点高于W的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,w的最高价氧化物的水化物酸性最强 |
5.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 标况下,22.4L单质溴所含有的原子数目为2NA | |
| C. | 2L 0.5 mol/L硫酸溶液中含有氢原子数目为2NA | |
| D. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA |
12.下列离子方程式书写正确的是( )
| A. | 用醋酸除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | |
| C. | 碘化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 硝酸亚铁溶液中滴加稀硫酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
2.对如图两种化合物的结构或性质描述错误的是( )
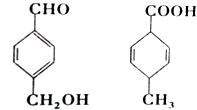

| A. | 互为同分异构体 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 均可以发生加成和取代反应 | |
| D. | 既能用红外光谱区分,也可以用核磁共振氢谱区分 |
6.用a、b两个质量相等的Pt电极电解AlCl3和CuSO4的混合溶液[n(AlCl3):n(CuSO4)=1:9].t1时刻a电极得到混合气体,其中Cl2在标准状况下为 224mL(忽略气体的溶解);t2时刻Cu全部在电极上析出.下列判断正确的是( )
| A. | a电极与电源的负极相连 | |
| B. | t2时,两电极的质量相差3.84 g | |
| C. | 电解过程中,溶液的pH不断增大 | |
| D. | t2时,b电极的电极反应是2H2O-4e-=2OH-+H2↑ |
7.含有一个三键的炔烃,加氢后产物的键线式为 ,这种炔烃有( )
,这种炔烃有( )
 ,这种炔烃有( )
,这种炔烃有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |