题目内容
20.工业利用冶铜炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制Fe2O3的生产流程示意图如下: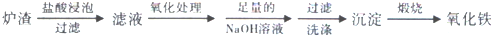
经“足量的NaOH溶液”处理后,铝元素的存在形态为( )
| A. | Al | B. | Al(OH)3 | C. | Al3+ | D. | [Al(OH)4]- |
分析 由流程可知,加盐酸时氧化铝反应生成氯化铝,滤液中加足量NaOH,反应生成偏铝酸钠,以此来解答.
解答 解:由流程可知,加盐酸时氧化铝反应生成氯化铝,滤液中加足量的NaOH溶液,发生Al3++4OH-═AlO2-+2H2O或Al3++4OH-═[Al(OH)4]-,铝元素的存在形态为[Al(OH)4]-,
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
10.下列溶液中的Cl-物质的量与100ml 1mol/L AlCl3溶液中Cl-物质的量相等的是( )
| A. | 150ml 1mol/LNaCl溶液 | B. | 100ml 3mol/L KClO3溶液 | ||
| C. | 75ml 2mol/L MgCl2溶液 | D. | 50ml 1mol/L FeCl3溶液 |
11.已知:①H2O(g)═H2O(l)△H=-Q1kJ/mol
②C2H5OH(g)═C2H5OH(l)△H=-Q2kJ/mol
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3kJ/mol
下列说法正确的是( )
②C2H5OH(g)═C2H5OH(l)△H=-Q2kJ/mol
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3kJ/mol
下列说法正确的是( )
| A. | 酒精的燃烧热△H=(Q2-Q3-3Q1)kJ/mol | |
| B. | 由③可知1molC2H5OH(g)的能量大于2molCO2(g)和3molH2O(g)的总能量 | |
| C. | H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应 | |
| D. | 23g液态酒精完全燃烧生成CO2(g)和H2O(l),放出的热量为(0.5Q2-0.5Q3-1.5Q1)kJ |
8.四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,Y、W同主族且能形成两种常见的化合物,X、W质子数之和是Z质子数的2倍.则下列说法中正确的是( )
| A. | 原子半径比较:X<Y<Z<W | |
| B. | Y的氢化物沸点高于W的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,w的最高价氧化物的水化物酸性最强 |
15.下列实验操作中,正确的是( )
| A. | 为了使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 | |
| B. | 分液时,分液漏斗中的两层液体均从下口放出 | |
| C. | 为加速固体物质的溶解可采用研磨、振荡、搅拌、加热等方法 | |
| D. | 为增大气体物质的溶解度,常采用搅拌,加热等措施 |
5.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 标况下,22.4L单质溴所含有的原子数目为2NA | |
| C. | 2L 0.5 mol/L硫酸溶液中含有氢原子数目为2NA | |
| D. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA |
12.下列离子方程式书写正确的是( )
| A. | 用醋酸除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | |
| C. | 碘化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 硝酸亚铁溶液中滴加稀硫酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
10.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 22.4L氯气和氢气的混合气体含有2NA个原子 | |
| B. | 0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 标准状况下,22.4L乙烯和丙烯的混合气体中含有的碳原子数目为2.5NA | |
| D. | 1molFeI2与1molCl2反应转移的电子数为2NA |