题目内容
16.在一定温度下,将H2和N2两种气体按不同比例通入相同的恒容密闭容器中,发生反应:3H2+N2$?_{催化剂}^{高温、高压}$2NH3.起始时H2和N2的物质的量之和相等,平衡后分别测出H2、N2的转化率.能正确表示H2、N2的转化率与起始时的关系图是( )| A. | 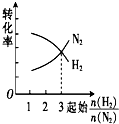 | B. | 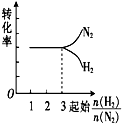 | C. | 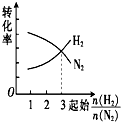 | D. | 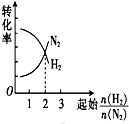 |
分析 两者的物质的量之和相等,对3H2+N2$?_{催化剂}^{高温、高压}$2NH3,增加氢气的物质的量平衡正向移动,氢气本身转化率降低,而氮气的转化率增加,当两者的物质的量之比等于化学计量数之比时,两者的转化率相等,由此分析解答.
解答 解:两者的物质的量之和相等,对3H2+N2$?_{催化剂}^{高温、高压}$2NH3,增加氢气的物质的量平衡正向移动,氢气本身转化率降低,而氮气的转化率增加,所以横向向右氮气的转化率增大,氢气的转化率减小,当两者的物质的量之比等1:3时,两者的转化率相等,故选A.
点评 本题考查了化学平衡移动影响因素的分析判断,图象分析应用,掌握变化实质是解题关键,题目难度中等.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案
相关题目
17.为了防止废弃塑料带来的“白色污染”,下列做法不可取的是( )
| A. | 回收各种废弃塑料 | B. | 将用过的塑料袋立即焚烧 | ||
| C. | 使用可降解塑料 | D. | 用布购物袋替代一次性塑料购物袋 |
4.已知A、B、C、D、E是短周期主族元素,原子序数依次增大.其中A、E的单质在常温下呈气态,B的原子最外层电子数是其电子层数的2倍,C在同周期主族元素中原子半径最大,D的周期序数与主族序数相同.下列说法正确的是( )
| A. | B位于元素周期表中第二周期第ⅥA族 | |
| B. | 工业上可以用电解CE溶液的方法同时获得C、E单质 | |
| C. | C、D的最高价氧化物对应的水化物之间能发生化学反应 | |
| D. | 化合物AE与CE具有相同类型的化学键 |
1.表为截取的元素周期表前4周期的一部分,且X、Y、Z、R和W均为主族元素.下列说法正确的是( )
| X | ||
| Y | Z | R |
| W |
| A. | Z的氧化物与X单质不可能发生置换反应 | |
| B. | X、Z原子序数可能相差18 | |
| C. | Z可能是氯元素 | |
| D. | 五种元素的原子最外层电子数一定都大于2 |
8.有4瓶常用溶液:①BaCl2溶液,②KCl溶液,③K2SO4溶液,④CuSO4溶液.不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是( )
| A. | ④③①② | B. | ①④②③ | C. | ①③④② | D. | ④①③② |
5.下列化学用语中正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 羟基的电子式: | ||
| C. | 1-丁烯的键线式: | D. | 乙醇的分子式:CH3CH2OH |
6.1摩某有机物在稀硫酸作用下,水解生成2摩相同的物质.下列物质中:
①蔗糖 ②麦芽糖 ③淀粉④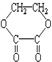 ⑤
⑤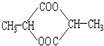 ⑥
⑥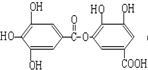 ⑦
⑦
符合题意的物质可能是( )
①蔗糖 ②麦芽糖 ③淀粉④
 ⑤
⑤ ⑥
⑥ ⑦
⑦
符合题意的物质可能是( )
| A. | ②⑤⑥⑦ | B. | ②④⑤⑦ | C. | ①②⑤⑦ | D. | ①④⑤⑥ |

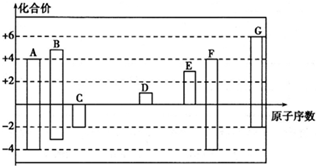
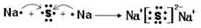 .其所含化学键类型为离子键.
.其所含化学键类型为离子键. .
.