题目内容
13.在指定条件下,下列各组离子一定能大量共存的是( )| A. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | 滴入KSCN显血红色的溶液中:NH4+、Mg2+、SO42-、Cl- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、K+、CO32-、NO3- |
分析 A.滴加甲基橙试剂显红色的溶液,显酸性;
B.滴入KSCN显血红色的溶液,含铁离子;
C.$\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液,显碱性;
D.由水电离出的c(H+)=1×10-13mol/L的溶液,为酸或碱溶液.
解答 解:A.滴加甲基橙试剂显红色的溶液,显酸性,Fe2+、NO3-发生氧化还原反应不能共存,故A不选;
B.滴入KSCN显血红色的溶液,含铁离子,该组离子之间不反应,可大量共存,故B选;
C.$\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液,显碱性,不能大量存在NH4+、Al3+,且Al3+、CO32-相互促进水解不能共存,故C不选;
D.由水电离出的c(H+)=1×10-13mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在CO32-,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
13.在标准状况下,VL氨气溶于水配成1L密度为ρg/cm3的氨水,该氨水的物质的量浓度为( )
| A. | $\frac{Vρ}{22400}$mol•L-1 | B. | $\frac{V}{22.4}$mol•L-1 | ||
| C. | $\frac{Vρ}{22400+17V}$mol•L-1 | D. | $\frac{1000Vρ}{22400+17V}$mol•L-1 |
4.电子产品产生的大量电子垃圾对环境构成了极大的威胁.某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如图制备硫酸铜和硫酸铝晶体的路线:
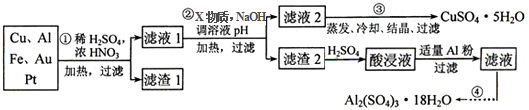
按要求回答下列问题:
(1)滤渣1中存在的金属有Au、Pt.
(2)已知沉淀物的pH如下表:
①则操作②中X物质最好选用的是d(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是4.4≤pH<4.9.
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是①取少量滤液于试管中,②向其中加入少量KSCN溶液,如果溶液不变红证明不存在Fe3+,③继续向溶液中滴入新制的氯水,如果溶液不变红证明不存在Fe2+.
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:Al+Fe3+=Fe+Al3+.
(5)由CuSO4•5H2O制备CuSO4时,应把CuSO4•5H2O放在坩埚(填仪器名称)中加热脱水.
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为 3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时负极反应式为Zn-2e-+2OH-=Zn(OH)2,每有1mol K2FeO4被还原,转移电子的物质的量为3mol,充电时阳极反应式为Fe(OH)3+5OH--3e-=FeO42-+4H2O.

按要求回答下列问题:
(1)滤渣1中存在的金属有Au、Pt.
(2)已知沉淀物的pH如下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是4.4≤pH<4.9.
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是①取少量滤液于试管中,②向其中加入少量KSCN溶液,如果溶液不变红证明不存在Fe3+,③继续向溶液中滴入新制的氯水,如果溶液不变红证明不存在Fe2+.
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:Al+Fe3+=Fe+Al3+.
(5)由CuSO4•5H2O制备CuSO4时,应把CuSO4•5H2O放在坩埚(填仪器名称)中加热脱水.
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为 3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时负极反应式为Zn-2e-+2OH-=Zn(OH)2,每有1mol K2FeO4被还原,转移电子的物质的量为3mol,充电时阳极反应式为Fe(OH)3+5OH--3e-=FeO42-+4H2O.
1.从2L、1L/mol的NaOH溶液中取出100mL溶液,下面关于这100mL溶液的叙述错误的为( )
①物质的量浓度为0.1mol/L
②物质的量浓度为1mol/L
③含有100mL水
④含有0.1molNaOH.
①物质的量浓度为0.1mol/L
②物质的量浓度为1mol/L
③含有100mL水
④含有0.1molNaOH.
| A. | ①② | B. | ①③ | C. | ③② | D. | ②④ |
18.某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
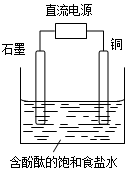

| A. | 石墨电极附近溶液呈红色 | B. | 铜电极上发生还原反应 | ||
| C. | 溶液中的Na+向石墨电极移动 | D. | 铜电极附近观察到黄绿色气体 |
5.下列关于1mol/L Na2SO4溶液的说法正确的是( )
| A. | 溶液中含有1molNa+ | |
| B. | 将142g Na2SO4溶于少量水后再稀释到 100mL | |
| C. | 1 mol Na2SO4溶于1 L蒸馏水中 | |
| D. | 1 L溶液中含有142 g Na2SO4 |
2.假设SiO2原子晶体中Si原子被Al原子取代,不足的价数由K原子补充.当有25%的硅原子被铝原子取代时,可形成正长石,则正长石的化学组成为( )
| A. | KAlSiO4 | B. | KAlSi2O6 | C. | KAlSi3O8 | D. | KAlSi4O10 |
3.根据有机化合物的命名原则,下列命名正确的是( )
| A. | CH3CH=C(CH3) CH3 3-甲基-2-丁烯 | |
| B. | CH3CH(CH3)CH(Cl)CH3 3-甲基-2-氯丁烷 | |
| C. | CH3CH(OH)CH2CH3 3-羟基丁醇 | |
| D. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |